Во время клеточного деления удваиваются и разделяются по двум дочерним клеткам все молекулы и органеллы материнской клетки. Удвоение ДНК происходит только в фазе S. У всех эукариот имеются сходные белковые комплексы, участвующие в инициации репликации и сходные белки, разрешающие репликацию. После образования, компоненты этого комплекса активируются циклин-зависимыми киназами. Начавшись, репликация ДНК должна быть завершена. Таким образом, внеклеточные сигналы типа ростовых факторов не могут и не должны влиять на прохождение S-фазы. Так как S-фаза независима от ростовых сигналов, то массивные повреждения ДНК или отсутствие нуклеотидов могут приводить к ее остановке, но часто такой арест завершается гибелью клетки.
После успешного завершения синтеза ДНК клетки переходят в G2-фазу и готовятся к митозу. Активированные в G2-фазе протеин-киназы предотвращают повторную репликацию. Покоящиеся клетки млекопитающих являются диплоидными, так что после удвоения ДНК они должны разделиться. То есть в G2-фазе контроль ростовых факторов также не нужен. Это время внутриклеточных сигналов, таких, как повреждение ДНК.
В процессе митоза циклин В/cdc2 фосфорилирует ламинин, белок ядерной мембраны, что приводит к растворению ядерной оболочки. В метафазе митоза конденсация хромосом совпадает с формированием митотического веретена. Эндоплазматический ретикулюм и комплекс Гольджи распадаются на маленькие пузырьки. Во время митоза хромосомы конденсированы, белки гиперфосфорилированы, а транскрипция и биосинтез резко ограничены или отсутствуют. Проходждение митоза определяется мониторингом функционирования микротрубочек, способствующих правильному расхождению хромосом. Внешний контроль ростовых факторов в такой момент представляется просто вредным, так что и митоз также является фазой цикла, независимой от них. В анафазе митоза две группы хромосом расходятся в разные стороны. Во время телофазы и цитотокинеза в клетке как бы в обратном порядке идет процесс восстановления внутриклеточных мембран. Вокруг ядер формируются оболочки, эндоплазматический ретикулум и комплекс Гольджи заново выстраиваются в цитоплазме. Микротрубочки разбираются. Транскрипция и биосинтез нормализуются, восстанавливаются внутриклеточные мембранные пути. Когда клетки вышли из митоза, они готовы к следующему клеточному циклу, допуская установление нового компетентного к репликации состояния в G1-фазе. Таким бразом, из простых логических умозаключений следует, что только G1-фаза клеточного цикла может зависеть от ростовых факторов.
Основные регуляторные события, приводящие к пролиферации, происходят в G1-фазе цикла. In vivo, так же, как и в клеточных культурах большинство покоящихся клеток имеют количество ДНК, соответствующее таковому в G1. Рост нормальных клеток в культуре регулируется комплексом взаимодействий между факторами роста, плотностью клеток и степенью их прикрепления к субстрату. Факторы роста необходимы для инициации и поддержания движения по фазе G1, приводящего к фазе S. Удаление ростовых факторов предотвращает наступление фазы S в нормальных клетках. Точка G1-фазы, после которой клетка не нуждается более в ростовых факторах для завершения клеточного цикла, была названа точкой рестрикции. Ее время было определено примерно за 2-3 часа до начала синтеза ДНК. Единожды в точке рестрикции или точке, после которой нет пути назад, клетки настраиваются на синтез ДНК и в дальнейшем не нуждаются во внеклеточных ростовых факторах в течение всего клеточного цикла. Предположили, что прохождение точки рестрикции, определяется накоплением лабильного (короткоживущего) белка.
Определение точки рестрикции могло бы быть маркером для различения нормальных и опухолевых клеток. Но какова ее биохимическая природа? R-белок предположительно является функциональным короткоживущим регуляторным белком, синтез которого чувствителен к ростовым факторам и который должен накопиться в достаточном количестве до того, как клетка пройдет точку рестрикции, и двинется вперед, к синтезу ДНК. К моменту постановки этого вопроса еще не были известны онкогены и пути передачи клеточных сигналов. Многие из впоследствии открываемых белков анализировали с точки зрения критериев R-белка.
Поиск специально экспрессирующегося в поздней G1-фазе и отсутствующего в покоящихся клетках белка, привел к нескольким различным вариантам. Это было сделано методом дифференциального дисплея. К сожалению, в том случае, если накопление белка происходит путем его стабилизации, данный метод не работает.
R-белок является короткоживущим белком, который индуцируется, стабилизируется в ответ на действие ростовых факторов, что ведет к независимости от них. Открытие циклинов D и E (G1-фазы) было крайне важным. Циклин D1, короткоживущий ядерный белок, накапливается под действием ростовых факторов. Он обычно оверэкспрессирован в опухолевых клетках. Тоже с циклином Е, данные которого отвечают всем требованиям к R-белку, включающим повышение в поздней G1, задержку появления после ингибирования синтеза белка в нетрансформированных клетках и быстрое восстановление в трансформированных клетках.
Движение по циклу осуществляется под действием Cdks. Их активаторы циклины нестабильны и их экспрессия циклична в течение клеточного цикла. Таким образом циклины контролируют активность Cdks и играют ключевую роль в регуляции клеточного цикла. За время прохождения клетки по циклу последовательно продуцируются четыре основных циклина – D, E, A, B. Циклин В ассоциирован с p34cdc2 и является триггером митоза. Движение по S-фазе требует наличия циклина А и его ассоциации с р33Cdk2. Циклины D и Е приводят клетку к S-фазе. Три типа циклина D: D1, D2, D3 очень похожи, но существенно отличаются от циклина Е. Во время клеточного цикла D-циклины начинают накапливаться в середине G1, в то время как циклин Е появляется позже, почти прямо перед переходом из G1 в S. Зависимое от митогенного сигнала продвижение по G1 связано с индукцией циклинов D-семейства. Факторы роста регулируют циклин D, как это показано на рис… четырьмя способами одновременно:
1. Индукция транскрипции,
2. Стабилизация белка циклина D,
3. Перемещение в ядро,
4. Объединение с их каталитическими партнерами Cdk-4 Cdk-6.
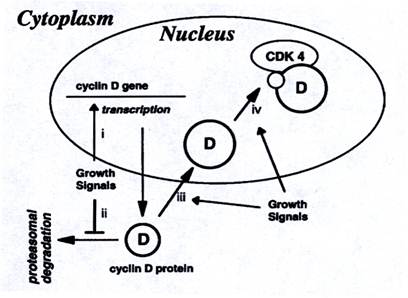
Рис…..Регуляция экспрессии циклина D
Промоторы D-циклинов отвечают на большое число митогенно-активирующихся сигналов, таких как Ras, β-катенин-Tcf/lef патвей. Индукция транскрипции циклина D1 зависит от Ras/Raf-1/Mek/ERK патвея. К тому же циклин D1 быстро деградирует и имеет короткое время существования. Важно подчеркнуть, что не только уровень циклинов D и Е, но и других белков, которые регулируют или осуществляют точку рестрикции, может повышаться путем стабилизации (как р53, обычно идущий путем протеосомной деградации без специального фосфорилирования). Подобным же образом протеосомной деградации подвергаются ингибиторы Cdks р27 и р21, сам циклин Е и транскрипционный фактор Е2F-1. Циклин D1 подвергается убиквитинированию и протеосомной деградации после фосфорилирования по треонину-286. Это фосфорилирование может быть ингибировано через сигнальный путь, в котором частично задействованы Ras, Pi3-киназа и протеинкиназа В (Act). Такой оборот циклина D1 является митоген-зависимым, а перенос в ядро и ассоциация с Cdk4 – митоген-независимым.
После объединения циклина D c Cdk в ядре, этот комплекс фосфорилирует белок Rb, нарушая его связывание с E2F, активирующим E2F-1 зависимую транскрипцию. Транскрипционный фактор E2F активирует транскрипцию генов, продукты которых вовлечены в ядерный метаболизм и синтез ДНК. Для понимания природы точки рестрикции нужно помнить, что E2F трансактивирует циклины Е и А. Циклин Е в комплексе с Cdk2 сотрудничает с циклин D – Cdks комплексами для полного фосфорилирования белка Rb. Циклин E- Cdk обладает более широкой активностью, чем циклин D- Cdk. К примеру, циклин E- Cdk фосфорилирует ингибитор CDK р27, что ведет к его деградации. Напротив, эти ингибиторы Cdks в низкой концентрации коактивируют циклин D – Cdks. Другой класс ингибиторов р15, р16 и р18 специально ингибируют циклин D – Cdks.
Факторы роста активируют собственные рецепторы и другие тирозинкиназы, Ras и митоген-активирующиеся патвеи, кульминацией которых является индукция транскрипции многочисленных генов, включая протоонкогены. Сходным образом, многие гены, кодирующие факторы роста, рецепторы, рецептор-ассоциированные белки и киназы все являются протоонкогенами.
Одним из важнейших «непоняток» в понимании регуляции клеточного цикла является связь митогенной стимуляции с машиной клеточного цикла. Экспрессия циклина D, его продвижение в ядро, стабилизация и ассоциация с Cdks4 или 6 в активный киназный комплекс регулируется ростовыми факторами. Следовательно, циклин D является сенсором ростовых факторов. Способность циклин D –зависимых киназ начинать фосфорилирование Rb в средней и поздней G1 показывает, что инактивация Rb как фактора супрессирующего клеточный рост, также является митоген-зависимым шагом. Rb участвует в контроле G1/S перехода, связывая семейство транскрипционных факторов E2F. Отсутствие функционально активной Rb достаточно для вхождения в фазу S в условиях, ограничивающих клеточный рост. E2F-1 накопление приводит к преодолению G1-ареста, являющегося результатом ингибирования активности G1 циклин-Cdks киназной активности. Зависимость от ростовых факторов заканчивается при фосфорилировании Rb, приводящем к проходу через точку рестрикции в средней G1 и дальнейшему движению по клеточному циклу. Достаточно ли этой способности циклинов D фосфорилировать Rb для того, чтобы считаться R-белками? Не полностью. Их способность быть сенсором факторов роста зависит не только от их быстрой индукции митогенным сигналом, но также от их белковой нестабильности, гарантирующей их быструю деградацию в клетках, лишенных ростовых факторов. То, сто циклины D являются короткоживущими белками гарантирует быстрое сокращение их пула при отсутствии митогенов. Индукции циклина D недостаточно для перехода покоящейся клетки через G1 в S.
Комплекс циклина Е с Cdk2 возникает позже по отношению к комплексу циклина D\ Cdk4 и завершает фосфорилирование Rb. Этот шифт между комплексами циклин Е\Cdk2 и циклин D\ Cdk4 объясняет потерю зависимости от факторов роста. Точнее, точка рестрикции расположена между циклином Е и циклином D. Переход из G1 в S сопровождается множественными петлями обратной связи, приводящими к ситуациям, при которых нижележащие события связаны с регуляцией самих себя на более высоком уровне. Например, и рRb2/р130 и р27 оба являются негативными регуляторами циклина Е. Экспрессия с-myc зависит от р21, CDKs и E2F, при том, что c-myc сам является регулятором р21 и CDKs.
Таким же образом циклин Е расположен ниже по отношению к Rb и E2F-1, так как он трансактивируется E2F-1. В тоже время завершение фосфорилирования Rb циклином Е и приводит к высвобождению E2F. Позитивная регуляция представляется необратимой. Тот же циклин Е, единожды экспрессировавшись становиться в дальнейшем независимым от митоген-зависимого циклина D. Таким образом, циклин Е является более удачным кандидатом на роль R- белка, чем циклин D. Зависимость от ростовых факторов заканчивается в момент полного фосфорилирования Rb, после чего клеткам остается только пройти через точку рестрикции и двигаться по циклу дальше. Таким образом и циклин D и циклин Е, а также и циклин А фосфорилируют Rb. R-белок разделяется, как минимум, надвое.
Кроме того, E2F-1 частично тоже обладает свойствами R-белка. Именно он необходим для продвижения в фазу S. Таким образом, расширяясь наши знания приводят к выводу о существовании не точки, а узла (knot) рестрикции. Современные представления о точке рестрикции показаны на рис….
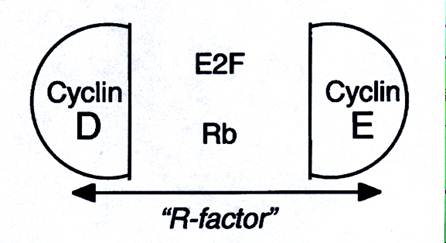
Рис…. Предсталение о природе точки рестрикции.
 2015-04-12
2015-04-12 3137
3137







