Равновесие химических реакций. Термодинамические функции химических реакций. Расчет изменения энтальпии, энтропии и теплоемкости химической реакции при нормальных условиях и заданной температуре.
Для хим.реакций равновесным считается состояние, в котором приходит система при постоянных внешних условиях, характеризуемый неизменностью во времени термодинамических параметров и отсутствием в системе потока вещества и теплоты.
Химическая термодинамика рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям.
1. Энтальпия реакция
Протекание хим.реакции сопровождается изменением энергии системы. Абсолютное значение энергии не может быть определено, т.к. нельзя привести систему в состояние лишенной энергии, но изменение энергии в результате протекания процесса можно определить, начиная отсчет от любого состояния в системе, условно присвоить его энергию равную 0. В общем случае энергия складывается из кинетической энергии движения системы в целом, потенциальной энергии, обусловленной положением системы в каком-либо внешнем поле и из внутренней энергии.
В хим.термодинамике рассматриваются неподвижные системы при отсутствие внешнего поля, тогда полная энергия системы равна внутренней.
Теплота, сообщенной системой, идет на изменение внутренней энергии
∆U= U2-U1
где U2,U1- внутренняя энергия исходной и конечной системы соответственно
Теплота также идет на преодоление сопротивлений, препятствующих изменению состояния системы, т.е. на совершение работы
Q=∆U+A
Если на систему действует только постоянное внешнее давление, то для бесконечно малого изменения состояния уравнение имеет вид:
δQ=dU+δA=dU+pdV
δQ - бесконечно малое количество теплоты
dU- полный дифференциал внутренней энергии системы
δA - бесконечно малое количество работ
Химическое превращение чаще всего происходит при постоянном объеме:
δQР=d(U+РV)
После интегрирования от U1 до U2 и от V1 до V2:
QР= U2 - U1 +РV2- РV1=(U2+ РV2)- (U1+ РV1)=Н2-Н1=∆Н
Изменение энтальпии реакции относится к системе и определяется её начального и конечного состояния.
Из закона Гесса вытекают следующие положения:
1. Теплота образования соединения из исходных веществ не зависит от способа получения этого соединения.
2. Теплота разложения соединения до определенных исходных веществ равна и противоположна по знаку теплоте образования соединения из этих веществ.
3. Если из 2-ух разных систем в результате различных процессов образуются одинаковые продукты, то разность между теплотами этих процессов равна теплоте перехода одной системы в другую.
При термодинамических расчетах необходимо все данные относить к одинаковым стандартным условиям, в которых все продукты в термодинамически устойчивом состоянии, т.е. р=0,1МПа, Т=298К.
Энтальпию химической реакции можно определить по теплотам образования, участвующих в ней простых веществ:
∆Н2980=∑(νi∆Нf2980)продукты- ∑(νi∆Нf2980)исх вещ-ва
2. Энтропия реакции
Энтропия характеризует направление процесса - это однозначная, непрерывная и конечная функция состояния системы. Следовательно, её изменение не зависит от пути агрегатного перехода, а определяется только конечными и начальными состояниями системы:
∆S=S2-S1=∑(νi∆Sf2980)продукты- ∑(νi∆Sf2980)исх вещ-ва
По знаку изменения энтропии процессы делятся на положительные (самопроизвольные) и отрицательные (несамопроизвольные). Т.е. зная знак ∆S можно говорить о направлении процесса.
3. Теплоемкости хим.реакции
Теплоемкость - физическая величина, определяемая отношением бесконечно малого количества δQ, полученного телом, к соответствующему приращению его температуры δT.
С= δQ/ δT
Для химического процесса изменение теплоемкости задается изменением состава системы и рассчитывается следующим образом:
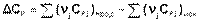
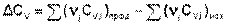
 2015-04-17
2015-04-17 1500
1500
