1. Сера. Краткая характеристика. Физические и химические свойства.
2. Глюкоза. Физические и химические свойства. Применение.
3. Задача № 14. Антуан-Лоран Лавуазье открыл природу горения различных веществ в кислороде после своего знаменитого двенадцатидневного опыта. В этом опыте он сначала длительное время нагревал в запаянной реторте навеску ртути, а позже (и при более высокой температуре) - образовавшийся на первом этапе опыта оксид ртути(II). При этом выделялся кислород, и Лавуазье стал вместе с Джозефом Пристли и Карлом Шееле первооткрывателем этого важнейшего химического элемента. Рассчитайте количество и объем кислорода (при н.у.), собранный при разложении 108,5 г HgO.
1. Сера(S) – это элемент, находящийся в главной подгруппе VI группы, в 3-м периоде. Порядковый (томный) номер 16. Заряд атома равен +16. Относительная атомная масса равна 32.
Сера – типичный активный металл. Она реагирует с простыми и сложными веществами. В химических реакциях сера может быть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств веществ, с которыми она реагирует. Сера проявляет свойства окислител я при взаимодействии с простыми веществами – восстановителями (металлами, водородом, некоторыми неметаллами, имеющие меньшую ЭО). Восстановителем сера является по отношению к более сильным окислителям (кислороду, галогенам и кислотам-окислителям).
S0 + 2e à S—2 (окислитель)
| S0 восстановитель | - 2e à | S+2 |
| - 4e à | S+4 | |
| - 6e à | S+6 |
| Взаимодействие серы с простыми веществами Сера реагирует | |
| Как окислитель: | Как восстановитель: |
| С металлами: 2Na0 + S0 = Na2+1S-2 (при t) Mg0 + S0 = Mg+2S-2 (при t) 2Al0 +3S0 = Al2+3S3-2 (при t) | С кислородом: S0 + O20 = S+4O2-2 (при t) |
| С углеродом: C0 + 2S0 = C+4S2-2 (при t) | С хлором: S0 + Cl20 = S+2Cl2-1 (при t) |
| С фосфором: 2P0 + 3S0 = P2+3S3-2 (при t) | С фтором: S0 + 3F20 = S+6F6-1 |
| С водородом: H20 + S0 = H2+1S-2 (при t) |
| Взаимодействие со сложными веществами |
| В воде сера не растворяется и даже не смачивается водой; |
| Как восстановитель сера взаимодействует с кислотами-окислителями (HNO3, H2SO4) при нагревании: |
S0 + 2H2S+6O4 = 3S+4O2 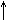 + 2H2O
Конц. + 2H2O
Конц.
|
S0 + 6HN+5O3 = H2S+6O4 +2N+2O 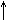 Разб.
Разб.
|
S0 +6HN+5O3 = H2S+6O4 +6N+4O2 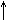 + 2H2O
Конц. + 2H2O
Конц.
|
| Проявляя свойства и окислителя, и восстановителя, сера вступает в реакции диспорционирования (самоокисления-самовосстановления) с растворами щелочей при нагревании: 3S0 + 6NaOH = 2Na2S-2 + 2NaS+4O3 + 3H2O S0 + 2e à S-2 2 S0 + 4e à S+4 1 |
 2015-04-17
2015-04-17 848
848








