-42-
ТЕОРИЯ ХИМИЧЕСКОЙ СВЯЗИ И СТРОЕНИЯ МОЛЕКУЛ
Межмолекулярное взаимодействие. Силы ван-дер-ваальса
|
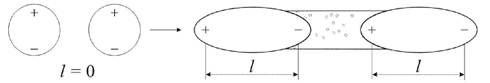
Рис. 3.14. Дисперсионное взаимодействие
Рассмотрим систему, состоящую из электронов и ядер. В любой момент времени вследствие несовмещения центров тяжести электронного облака и ядра такая система представляет собой мгновенный диполь, направление диполей соответствует движению электронов и непрерывно меняется. Каждый из диполей будет влиять на ориентацию подобных мгновенных диполей в соседних молекулах. Движение всех диполей системы перестает быть независимым и становится синхронным (рис. 3.14), возникают межмолекулярные силы дисперсионного взаимодействия.
Контрольные вопросы и задания
1. Почему атомы соединяются в молекулы? Как изменяется их энергия?
2. Какова природа химической связи?
3. Как по длине и энергии связи оценить ее прочность?
4. Какие существуют виды ковалентной химической связи? Привести примеры.
5. Какие существуют механизмы образования ковалентной связи? Чем они отличаются?
6. Что такое гибридизация? Как она влияет на прочность связи?
7. Назвать причины направленности ковалентной связи. Привести примеры.
8. Существует ли стопроцентная ионная или ковалентная связь?
9. Почему полярные молекулы называют диполями?
10. Полярность и поляризуемость химической связи - понятия разные или одинаковые?
11. Влияет ли природа взаимодействующих атомов на полярность молекул? Привести примеры.
12. Охарактеризовать водородную связь, её виды и влияние на физические и химические свойства веществ.
13. Рассказать о силах межмолекулярного взаимодействия, их природе.
14. Как устроена металлическая кристаллическая решетка?
15. Чем отличается металлическая связь от ковалентной?
16. Почему металлы хорошо проводят электричество и тепло, ковки и пластичны?
 2015-04-01
2015-04-01 546
546








