Один градус жесткости соответствует содержанию 1 г оксида кальция (CaO) в 100 л воды. Содержание других металлов пересчитывается на количество эквивалентов CaO. Воду, жесткость которой равна до 4 ммоль/л, считают мягкой, свыше 12 ммоль/л – очень жесткой.
Выразим жесткость воды (ммоль/л) через массу двухзарядных катионов металлов Ca2+, Mg2+, Fe2+ и соответствующих им солей, содержащихся в 1 л воды:
Ж = 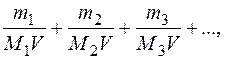
где m 1, m 2, m 3 – массы двухзарядных катионов металлов (или соответствующих им солей) в воде, мг; М 1, М 2, М 3 – молярные массы эквивалентов катионов металлов (или соответствующих им солей); V – объем воды, л.
Определяем молярные массы эквивалентов солей, обусловливающих жесткость воды:
Ca(HCO3)2
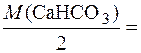
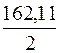 = 81,05 мг/моль;
= 81,05 мг/моль;
Mg(HCO3)2
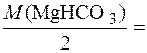
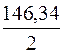 = 73,17 мг/моль;
= 73,17 мг/моль;
CaCl2
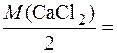
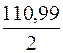 = 55,49 мг/моль;
= 55,49 мг/моль;
MgCl2
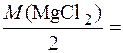
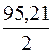 = 47,60 мг/моль.
= 47,60 мг/моль.
Общая жесткость данного образца воды равна сумме временной и постоянной жесткости и обусловливается содержанием в ней солей, придающих ей жесткость; она равна
Жобщ. = 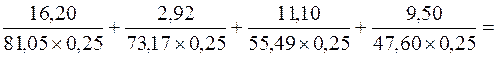
= 0,80 + 0,16 + 0,80 + 0,80 = 2,56 ммоль/л.
Один градус жесткости соответствует 0,357 ммоль катионов двухзарядных металлов. Общая жесткость образца воды в градусах жесткости равна 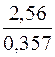 = 7,17 о. Вода данного образца считается мягкой.
= 7,17 о. Вода данного образца считается мягкой.
Пример 2.2. Определение временной и постоянной жесткости воды по количеству реагентов, необходимых для устранения жесткости.
Для устранения общей жесткости по известково-содовому методу к 30 л воды добавлено 5,3 г Ca(OH)2 и 4,5 г Na2CO3. Рассчитайте временную и постоянную жесткость воды.
Решение
Добавлением в воду гашенной извести (Ca(OH)2) можно удалить временную жесткость, а введением соды (Na2CO3) устранить постоянную жесткость. Данные процессы идут по следующим реакциям:
Me(HCO3)2 + Ca(OH)2 = MeCO3 + CaCO3 + 2H2O;
Me(NO3)2 + Nа2CO3 = MeCO3 + 2NaNO3,
где Me2+: Ca2+, Mg2+, Fe2+ и др.
Временную жесткость воды Жвр. измеряют количеством гидроксида кальция, участвующего в реакции, а постоянную жесткость Жпост. – количеством карбоната натрия.
Жвр. = 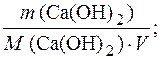
Жпост. = 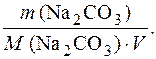
M (Ca(OH)2) = M /2 = 74,09/2 = 37,04 моль/л;
M (Na2CO3) = M /2 = 106,00/2 = 53,0моль/л;
Жвр = 5300/37,04×30 = 4,7 ммоль/л;
Жпост.= 4500/53×30 = 2,8ммоль/л;
Жобщ.= Жвр+ Жпост = 4,7 + 2,8 = 7,5 ммоль/л (вода средней жесткости).
Задача 2.1. Определите общую жесткость (Ж) воды по массе содержащихся в воде солей.
| Вариант | Объем воды, л | Ca(HCO3)2, мг | Mg(HCO3)2, мг | CaCl2, мг | MgCl2, мг |
| 0,15 | 18,2 | 2,2 | 13,2 | 10,1 | |
| 0,20 | 10,3 | 1,5 | 7,3 | 8,5 | |
| 0,25 | 25,1 | 3,12 | 20,1 | 11,12 | |
| 0,30 | 11,5 | 4,2 | 8,2 | 11,2 | |
| 0,33 | 12,2 | 2,9 | 8,1 | 9,9 | |
| 0,35 | 13,6 | 3,1 | 10,1 | 10,1 | |
| 0,40 | 14,7 | 2,7 | 9,2 | 9,7 | |
| 0,45 | 15,3 | 2,1 | 10,3 | 11,3 | |
| 0,50 | 16,2 | 1,9 | 11,2 | 8,5 | |
| 0,55 | 17,1 | 2,0 | 12,1 | 10,0 | |
| 0,60 | 18,5 | 1,7 | 13,5 | 8,9 | |
| 0,65 | 19,6 | 2,6 | 14,6 | 9,6 | |
| 0,70 | 20,7 | 2,8 | 15,7 | 9,8 | |
| 0,75 | 21,8 | 1,5 | 16,8 | 8,7 | |
| 0,80 | 22,1 | 1,3 | 17,2 | 8,9 | |
| 0,85 | 23,2 | 2,1 | 18,1 | 9,9 | |
| 0,90 | 24,5 | 2,2 | 19,3 | 10,3 | |
| 0,95 | 19,1 | 3,0 | 15,3 | 10,0 | |
| 16,2 | 2,9 | 11,5 | 9,9 | ||
| 0,10 | 13,3 | 2,67 | 10,1 | 9,67 | |
| 0,52 | 11,4 | 3,77 | 7,7 | 11,0 | |
| 0,78 | 17,5 | 4,1 | 12,5 | 12,5 | |
| 0,38 | 15,6 | 2,33 | 10,6 | 11,46 | |
| 0,29 | 19,7 | 2,65 | 15,7 | 9,57 | |
| 0,44 | 23,8 | 2,56 | 18,5 | 9,88 | |
| 0,88 | 26,1 | 3,77 | 21,1 | 12,3 | |
| 0,66 | 22,2 | 2,55 | 17,4 | 14,1 | |
| 0,22 | 15,3 | 3,12 | 11,0 | 12,6 | |
| 0,13 | 18,4 | 1,76 | 14,4 | 14,0 | |
| 0,96 | 19,5 | 2,37 | 15,5 | 11,1 | |
| 0,67 | 20,7 | 2,98 | 16,6 | 10,7 | |
| 0,78 | 21,1 | 2,74 | 14,7 | 9,54 |
Задача 2.2. Определите временную и постоянную жесткость по известково-содовому методу.
| Вариант | Объем воды, л | m (Ca(OH)2), г | m (Na2CO3), г |
| 6,2 | 5,1 | ||
| 5,5 | 3,4 | ||
| 8,5 | 5,5 | ||
| 6,5 | 4,0 | ||
| 7,5 | 4,5 | ||
| 7,9 | 4,5 | ||
| 7,4 | 5,3 | ||
| 9,0 | 7,0 | ||
| 12,5 | 10,1 | ||
| 13,5 | 10,6 | ||
| 13,0 | 9,8 | ||
| 14,5 | 9,8 | ||
| 15,5 | 10,5 | ||
| 16,0 | 12,0 | ||
| 12,0 | 9,5 | ||
| 11,3 | 9,5 | ||
| 7,8 | 5,5 | ||
| 9,3 | 6,5 | ||
| 9,8 | 6,7 | ||
| 7,6 | 5,4 | ||
| 6,8 | 5,3 | ||
| 9,6 | 6,3 | ||
| 7,5 | 4,6 | ||
| 6,9 | 4,4 | ||
| 7,8 | 5,5 | ||
| 13,4 | 8,9 | ||
| 8,6 | 6,0 | ||
| 9,4 | 7,0 | ||
| 9,7 | 6,8 | ||
| 14,5 | 12,0 | ||
| 13,7 | 9,0 | ||
| 11,6 | 8,5 |
Задача 2.3. Для умягчения Х л воды потребовалось Y г Na2CO3. Чему равна постоянная жесткость воды?
| Вариант | Х л воды | Y г Na2CO3 |
| 12,8 | ||
| 13,5 | ||
| 14,5 | ||
| 13,0 | ||
| 15,0 | ||
| 14,7 | ||
| 13,3 | ||
| 16,0 | ||
| 16,5 | ||
| 17,0 | ||
| 8,9 | ||
| 9,8 | ||
| 9,5 | ||
| 8,5 | ||
| 15,5 | ||
| 13,9 | ||
| 19,0 | ||
| 17,0 | ||
| 16,0 | ||
| 16,5 | ||
| 6,9 | ||
| 9,8 | ||
| 10,6 | ||
| 11,5 | ||
| 12,5 | ||
| 11,8 | ||
| 12,9 | ||
| 14,3 | ||
| 10,5 | ||
| 12,7 | ||
| 14,6 | ||
| 13,8 |
 2015-04-06
2015-04-06 1674
1674
