Содержание растворенного вещества (р.в.) в растворе (р-р) можно выразить либо безразмерными единицами – долями или процентами, либо еличиинами размерными – концентрациями. В таблице 9 приведены некоторые способы выражения состава растворов:
Таблица 9 Способы выражения концентраций растворов
| Способы выражения содержания р.в. в р-ре | Обозначения и единицы измерения | Математические выражения | Размерности | |
| р.в. | р-ра | |||
| Массовая доля, ω | m – масса (г, кг …) | m = 100 единиц массы (г, кг …) | 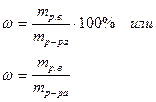
| % - |
| Молярная концентрация или молярность, См | nМ – число молей | V=1л | 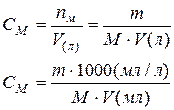 М – молярная масса, г/моль
М – молярная масса, г/моль
| 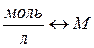
|
| Эквивалентная концентрация или нормальность, Сн, N | nЭ -число моль-эквивалентов | V = 1л | 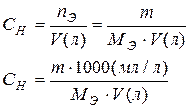 МЭ – молярная масса эквивалента; г/моль-экв.
МЭ – молярная масса эквивалента; г/моль-экв.
| 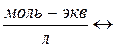 н н
|
| Титр, Т | m- масса, г | V=1 мл | 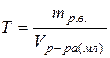
| 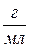
|
Решение задач на переход от одного способа выражения состава раствора к другому основано на использовании математических соотношений между различными единицами измерения компонентов растворов:
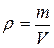
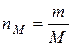
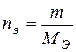
Пример 1
СМ → ω; СН → ω
1) Найти массу 1 л раствора (1 л = 1000 мл)
mр-ра = ρ · V = ρ · 1000
2) Определить массу растворенного вещества в 1 л раствора
mр.в = СМ · М · Vр-ра; mр.в = СН · МЭ · Vр-ра; Vр-ра = 1 л
3) Вычислить массовую долю растворенного вещества
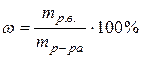
Пример 2.
ω → СМ; ω → СН
1) Найти массу 1 л раствора (см. пример 1)
2) Определить массу растворенного вещества в 1 л раствора
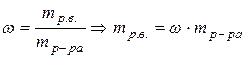
3) Вычислить число молей (моль-экв) растворенного вещества в 1 л раствора, т.е. См (СН):
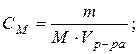
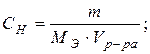 Vр-ра = 1 л
Vр-ра = 1 л
Пример 3
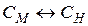

 1 моль-экв
1 моль-экв 

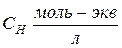
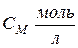 СН = СМ · n
СН = СМ · n 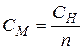
n – число реакционноспособных химических связей в веществе.
Для реакций, протекающих в растворах, состав которых выражен эквивалентной концентрацией, закон эквивалентов можно записать так:
СН,1 · V1 = СН,2 · V2 или N1 · V1 = N2 · V2
V – объем раствора, мл или л.
Эквивалентная концентрация растворов связана с его титром соотношением:
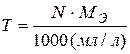
5 Электролитическая диссоциация.
Реакции электролитов как реакции ионов.
Электролиты – вещества, водные растворы и расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания, соли.
Электролитическая диссоциация – процесс распада электролита на ионы под воздействием молекул растворителя.
Примеры:
HCl ↔ H+ + Cl-
H3PO4 ↔ H+ + H2PO-4 ↔ 2H+ + HPO42- ↔3H+ + PO43-
KOH ↔ K+ + OH-
Mg(OH)2 ↔ MgOH+ + OH- ↔ Mg2+ + 2OH-
Al2(SO4)3 ↔ 2Al3+ + 3SO42-
KAl(SO4)2 ↔ K+ + Al3+ + 2SO42-
Ca(HCO3)2 ↔ Ca2+ + 2HCO3-
AlOHCl2 ↔ AlOH2+ + 2Cl-
Поскольку вещества электронейтральны, общее число положительных зарядов катионов равно общему числу отрицательных зарядов анионов.
По степени электролитической диссоциации (α) различают электролиты: сильные (α > 30%), средние (2% < α < 30%), слабые (α < 2-3%).
Сильные электролиты:
- многие минеральные кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4, HClO3, HMnO4;
- основания щелочных и щелочноземельных металлов;
- почти все растворимые соли (исключения: HgCl2, CdCl2, CdI2, Fe(CNS)3 и некоторые другие);
Слабые электролиты:
- некоторые минеральные кислоты: H2CO3, H2S, H2SO3, HNO2, HClO;
- органические кислоты;
- Н2О
- NH4OH, основания большинства металлов (кроме щелочных и щелочноземельных).
Ортофосфорная кислота Н3РО4 – электролит средней силы.
По теории электролитической диссоциации все реакции электролитов в водных растворах являются реакциями между ионами. Такие реакции представляют в виде ионных уравнений. При составлении ионных уравнений реакций каждое вещество записывается в той форме, которая для данного равновесного состояния в растворе является преобладающей; поэтому в виде ионов изображают только сильные растворимые электролиты, все остальные вещества (малодиссоциированные, малорастворимые, газообразные, а также неэлектролиты) записываются в молекулярном виде. Знак ↓ при формуле вещества показывает, что это вещество удаляется из сферы реакции в виде осадка, знак ↑ - в виде газа.
 2015-04-30
2015-04-30 395
395








