Теоретические основы. Окислительно-восстановительныминазываютсяреакции, при которых происходит переход электронов от одних частиц (атомов, молекул или ионов) к другим, в результате чего изменяется степень окисления данных частиц. Процесс отдачи электронов называется окислением; вещество, атомы которого отдают электроны, называется восстановителем. Восстановительными свойствами обладают, как правило, молекулы водорода, атомы металлов в свободном состоянии, а также ионы, в которых элемент находится в низшей степени окисления или степень окисления которого может возрасти. В лаборатории в качестве восстановителей обычно применяют H2 , KI, H2S, HNO2.
Процесс присоединения электронов называется восстановлением, а восстанавливающая частица - окислителем. Окислителями часто являются молекулы и ионы, содержащие элемент в высшей степени окисления, например: MnO4  , Cr2O72
, Cr2O72  , Ni 3+ и т.д.
, Ni 3+ и т.д.
Окислительно-восстановительные свойства вещества определяют по их окислительной способности, числено выражаемый через редокс- потенциал j. Реальный потенциал рассчитывается по уравнению Нернста:
 j = j 0+
j = j 0+ 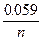 lg(Cок / C восст),
lg(Cок / C восст),
где j 0 - стандартный электродный потенциал данного процесса, n- количество принятых электронов, Cок и C восст - концентрации окисленной и восстановленной форм соответственно.
Чем больше значение j, тем сильнее окислительные свойства окисленной формы данного соединения.
Все окислительно-восстановительные реакции можно разделить на три группы:
1). реакции межмолекулярного окисления-восстановления - это реакции в которых обмен электронами происходит между атомами, находящимися в различных молекулах: Fe + CuSO4 = FeSO4 + Cu.
2). реакции внутримолекулярного окисления-восстанов-ления - в таких реакциях окислитель и восстановитель находятся в одном и том же веществе: 2КClO3 = 2KCl + 3O2.
3). реакции диспропорционирования, в которых одни и те же атомы в молекулах взаимодействуют друг с другом как окислитель с восстановителем, вследствие того, что эти атомы имеют промежуточные степени окисления и являются одновременно окислителем и восстановителем:
3К2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
Cоставление уравнений реакций окислисления-восстановления. Такие уравнения можно составлять как методом электронного баланса, так и ионно-электронным методом (методом полуреакций). В основе обоих методов лежит общий принцип: количество отданных и принятых электронов в реакции должны быть равно.
Метод электронного баланса основан на сравнении степени окисления атомов в исходных и конечных веществах. Им рекомендуется пользоваться в тех случаях, когда реакция протекает не в растворах (обжиг, разложение, горение).
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
 O2 + 4 e = 2O2
O2 + 4 e = 2O2 
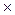 11
11
 |
Fe 2+ - e = Fe3+
2S  - 10 e = 2S4+
- 10 e = 2S4+ 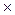 4
4
Метод полуреакций основан на составлении ионных уравнений для процессов окисления и восстановления с учетом рН среды данной реакции, оказывающей определенное влияние на направление протекания реакции. Сильные электролиты в данном методе записываются в виде ионов, слабые - в виде молекул. В ионную схему включают ионы и молекулы, проявляющие окислительно-восстановительные свойства, а также ионы, характеризующие среду (в кислой среде - ионы Н+ и молекулы воды, в щелочной среде - ионы ОН  и молекулы воды, в нейтральной среде - молекулы воды, ионы Н+ или ОН
и молекулы воды, в нейтральной среде - молекулы воды, ионы Н+ или ОН  ):
):
Ca + HNO3 (разб) 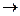 NH4NO3 +...
NH4NO3 +...
 Ca0 - 2 e
Ca0 - 2 e  Ca2+
Ca2+  4
4
NO3  + 10H+ + 8 e
+ 10H+ + 8 e  NH4+ + 3H2O
NH4+ + 3H2O  1
1
 |
4Ca0 + NO3  + 10H+
+ 10H+ 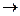 4Ca2+ + NH4+ + 3H2O
4Ca2+ + NH4+ + 3H2O
4Ca + 10HNO3 (разб) 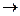 4Ca(NO3)2 + NH4NO3 + 3H2O
4Ca(NO3)2 + NH4NO3 + 3H2O
Цель работы. Изучение окислительно-восстанови-тельных свойств различных веществ, типов окислительно-восстановительных реакций, а также методов составления уравнений окислительно-восстановительных реакций (ОВР).
Порядок работы.
Опыт 1. Окислительные свойства перманганата калия
в различных средах.
В три пробирки налейте по 5 капель раствора KMnO4. Затем в первую добавьте 5 капель 2N раствора серной кислоты, во вторую - 5 капель дистиллированной воды, а в третью - 5 капель 2N раствора щелочи.
После этого во все три пробирки добавьте по каплям раствор сульфита натрия Na2SO3 до видимого изменения цвета растворов.
Напишите наблюдения и уравнения реакций, учитывая, что окраска соединений марганца зависит от его степени окисления: ион MnO4  - имеет фиолетовую окраску, ион MnO42
- имеет фиолетовую окраску, ион MnO42  - имеет зеленую окраску, ион Mn2+ - практически бесцветен, оксид марганца MnO2 - труднорастворимое вещество бурого цвета.
- имеет зеленую окраску, ион Mn2+ - практически бесцветен, оксид марганца MnO2 - труднорастворимое вещество бурого цвета.
Опыт 2. Реакции внутримолекулярного окисления -
восстановления.
 2015-04-30
2015-04-30 1946
1946
