Глава 2. Физика твердого тела
Классификация лазеров по типу рабочео тела.
а. Твердотельные лазеры на люминесцирующих средах с оптической накачкой. Это рубиновые и лазеры на стеклах, активированные неодимом. Работают в импульсном режиме.
б. Газоразрядные лазеры низкого давления на смесях He-Ne, He-Xe, непрерывного действия, генерируют излучение высокой монохроматичности и направленности.
в. Полупроводниковые лазеры с инжекционной накачкой через р-n переход. (Подробнее см. параграф 16). Миниатюрны, могут работать в импульсном и непрерывном режимах.
г. Газоразрядные лазеры высокого давления (N2-CO2, CO). Мощность – десятки кВт. Могут работать в непрерывном и импульсном режимах.
К настоящему времени разработаны так же газоразрядные аргоновые лазеры непрерывного действия, генерирующие зелёный луч, жидкостные лазеры на красителях, химические лазеры на смеси газов, работающие за счёт энергии химической реакции, и др.
1. Современная квантовая теория твердого тела (ТТ) рассматривает ТТ как систему частиц, в которой действуют кулоновские электрические силы. Магнитное взаимодействие между атомами в кристаллической решетке ТТ гораздо слабее, чем электрическое. Это позволяет часто им пренебрегать.
Точное решение уравнения Шредингера для многочастичной системы, каковой является кристалл, упирается в непреодолимые математические трудности. Ситуация напоминает проблему решения системы уравнений движения молекул, например, в объеме газа. В молекулярной физике выход найден во введении средних характеристик движения молекул и таких интегральных специфических параметров, как давление и температура.
В физике твердого тела задача решается с помощью приближенных методов. Например, в теории металлов вместо многих электронов рассматривается один электрон, движущийся в постоянном периодическом поле кристаллической решётки.
2. Энергетические зоны. Одинаковые атомы, бесконечно удаленные друг от друга, имеют одинаковые энергетические уровни. Если эти атомы постепенно сближать, то их электронные облака перекрываются. Энергетические уровни такой системы связанных общими электронами атомов расщепляются. Возникают энергетические полосы или зоны.
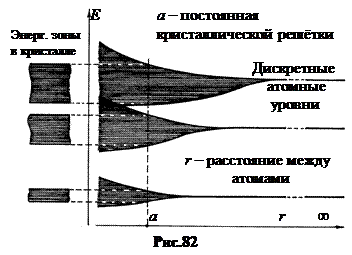
Любой монокристалл можно рассматривать как одну большую молекулу. Если постепенно наращивать кристалл, то каждый последующий атом будет создавать дополнительное расщепление энергетических уровней. Ширина полос определяется расстоянием между атомами. Поэтому каждый последующий атом не делает полосы шире. Он лишь увеличивает число энергетических уровней в постоянной по ширине полосе. Сильнее всего расщепляются внешние уровни. Чем ниже уровень, тем слабее он расщепляется (рис.82).
Сравним величину энергетических ступеней в полосе с энергией теплового движения. В качестве примера рассмотрим кристалл натрия. Допустим, полоса образуется расщеплением уровня 4 s и ширина этой полосы не больше разности энергий между уровнями 3 s и 5 s. Как видно из рис.44, это составляет около 4 эВ.
Допустим, кристалл натрия имеет объем 1 см3. При плотности натрия r» 103 кг ç м3 масса m кристалла составляет 1 г = 10-3 кг. Число атомов в таком кристалле N = (mçM)· Na = (10-3 ç 0,023)·6·1023 » 1023.
Число энергетических уровней в каждой энергетической зоне кристалла по крайней мере не меньше числа атомов N. Будем полагать, что оно равно N. Тогда расстояние между уровнями в полосе 4s кристалла натрия составляет 4 эВ ç 1023 » 6·10-42 Дж.
Энергия теплового движения даже при температуре 1 К составляет величину порядка kТ = 1,38·10-23Дж. Она примерно на 20 порядков превосходит ширину энергетических ступеней в полосе. Поэтому в кристаллах при Т > 0 К, электроны в энергетических полосах при наличии свободных уровней могут перепрыгивать на них в пределах полос за счет энергии теплового движения.
Различают разрешенные зоны, то есть зоны – полосы, состоящие из разрешенных уровней, на каждом из которых могут находиться электроны (не более одного электрона на каждом уровне в разрешённой зоне), и запрещенные энергетические зоны, то есть области, где нет разрешённых уровней, и где электроны находиться не могут.
3. Проводники, диэлектрики и полупроводники. Энергетическую зону, возникшую из того уровня, на котором находятся валентные электроны в основном (не возбужденном) состоянии атома, называют валентной зоной. В зависимости от степени заполнения валентной зоны электронами и ширины выше расположенной запрещенной зоны возможны три случая (рис.83).
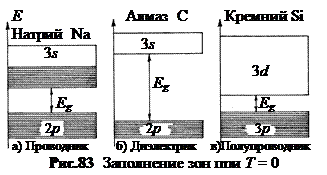
а. Проводники (рис.83-а). Рассмотрим в качестве примера натрий. В изолированном и невозбужденном атоме натрия в 3 s -состоянии находится один валентный электрон. Максимально возможное число электронов в 3 s -состоянии равно двум. При объединении атомов натрия в кристалл уровни расщепляются, но соотношение между заполненными и свободными вакансиями сохраняется. В результате в кристалле натрия образуется валентная зона, заполненная электронами при температуре абсолютного нуля наполовину. Поэтому достаточно сообщить электронам, находящимся на верхних уровнях, ничтожную энергию порядка 10-42 Дж, чтобы они приобрели возможность перехода на более высокие уровни. Эта возможность реализуется при любых температурах, отличных от абсолютного нуля. В результате электроны могут ускоряться электрическим полем и приобретать скорость направленного движения. Это металлы (Au, Cu, Ag, Na, K, Li...). Валентную зону в металлах называют зоной проводимости.
Электрическая проводимость в кристаллах оказывается возможной потому, что валентные и более высокие разрешенные зоны соседних атомов в кристаллах перекрываются. Валентные электроны в кристаллической решетке металлов обобществляются между всеми атомами. В результате возникает зона проводимости, пронизывающая весь кристалл.
б. Диэлектрики (рис.83-б). В них при температуре абсолютного нуля Т = 0 электроны заполняют валентную зону полностью. В кристалле существуют зоны двух типов: до конца заполненные и совсем пустые. Такой кристалл при Т = 0 не проводит электрический ток и является диэлектриком (изолятором). При наложении на кристалл диэлектрика внешнего электрического поля (с напряженностью не большей напряженности пробоя кристалла), валентные электроны в таких кристаллах остаются на своих местах, ибо нет близко расположенных свободных уровней, на которые они могли бы перейти.
в. Полупроводники (рис.83-в). Кристалл с заполненной валентной зоной при нагревании ведет себя по-разному в зависимости от ширины запрещенной зоны Еg. Кристаллы с широкой запрещенной зоной являются диэлектриками вплоть до высоких температур. Твердых диэлектриков одноэлементного состава сравнительно мало. Это сера S, алмаз C, кристаллический азот N и др. Их диэлектрические свойства сохраняются вплоть до температур фазовых переходов. У алмаза, например, температура превращения алмаз®углерод составляет 1400°С. Более распространенными высокотемпературными диэлектриками являются оксиды SiO2 (кварц), TiO2 (рутил), Al2O3 (глинозем) и др. Обычно к диэлектрикам относят кристаллы с шириной запрещенной зоны Еg > 3 эВ. Например, у алмаза Еg = 5,2 эВ, у глинозема Еg = 7 эВ. Если ширина запрещенной зоны невелика, так что при нагревании кристалла до нескольких сот кельвин тепловой энергии оказывается достаточно для перехода электронов из валентной в свободную зону, то диэлектрик превращается в проводник. Свободная зона при переходе в нее электронов становится зоной проводимости. Такие кристаллы с малой шириной запрещенной зоны называются полупроводниками. При низких температурах они приближаются к диэлектрикам, при высоких – к проводникам. У типичных полупроводников Еg » 1 эВ. Например, у германия Ge Еg = 0,66 эВ, у кремния Si Еg = 1,08 эВ, у арсенида галлия GaAs Еg = 1,43 эВ, у антимонида индия InSb Еg = 0,17 эВ.
Резкой границы между диэлектриками и полупроводниками нет, и в реальных диэлектриках при Т > 0 в зоне проводимости всегда есть некоторое количество электронов. Оно тем больше, чем меньше ширина запрещенной зоны и чем выше температура.
Это число может составлять 1012¸1015 эл ç см3, что много меньше количества электронов в зоне проводимости металлов (1020¸1023 эл ç см3). Концентрация электронов в зоне проводимости возбужденных полупроводников заключена между этими границами и составляет 1018¸1019 эл ç см3.
4. Поверхность Ферми. Сравним распределение электронов проводимости в металлах с распределением Максвелла-Больцмана молекул идеального газа при Т = 0.
Классический газ при Т = 0 должен прекратить свое существование, поскольку энергия его частиц обращается в нуль, 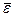 = 3 кТç 2 = 0. Следовательно, обращается в нуль и скорость движения частиц.
= 3 кТç 2 = 0. Следовательно, обращается в нуль и скорость движения частиц.
С электронами проводимости дело обстоит иначе. При Т ® 0 энергия электронов проводимости в кристалле не может стремиться к нулю, так как иначе все электроны перейдут в одинаковое состояние с нулевой энергией. Но это запрещено принципом Паули. При Т = 0 электроны проводимости располагаются на энергетической лесенке, начиная с самой нижней ступеньки и плотно заполняя все разрешенные энергетические уровни и состояния так, что на каждом из них находится по одному электрону.
Функция плотности q (Е) распределения разрешённых уровней электронов проводимости в металле объёмом V по энергиям Е имеет вид: q (Е) =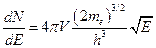 . (12.1)
. (12.1)
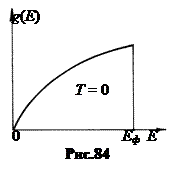
График функции q (Е) показан на рис.84. Верхний из заполненных при Т = 0 К уровней зоны проводимости металла называют уровнем Ферми, а его энергию – энергией Ферми Еф. Величина Еф при Т = 0 определяется выражением: Еф =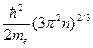 , (12.2) где n – концентрация свободных электронов в металле. У одновалентных щелочных металлов концентрация свободных электронов равна концентрации узлов решётки.
, (12.2) где n – концентрация свободных электронов в металле. У одновалентных щелочных металлов концентрация свободных электронов равна концентрации узлов решётки.
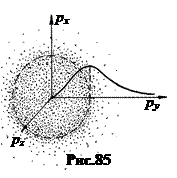
В пространстве импульсов, откладывая по осям проекции px, py, pz импульсов частиц, можно получить наглядную геометрическую картину распределения частиц по энергиям. Так, распределение Максвелла-Больцмана для идеального газа при Т > 0 К выглядит в таком представлении как центрально – симметричная туманность с увеличивающейся к центру концентрацией частиц (рис.85). Чем больше энергия частиц, тем дальше они от центра. При Т ® 0 К туманность стягивается в центральную точку. С ростом температуры туманность увеличивается в размерах.
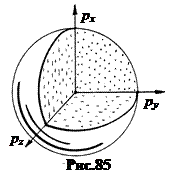
В отличие от классического газа изоэнергетические поверхности электронов в зоне проводимости металлов образуют в импульсном пространстве более сложную форму. Поверхность, соответствующую уровню Ферми, называют поверхностью Ферми. Вид этой поверхности существенно сказывается на многих электрических, магнитных и других свойствах металлов. Это позволяет построить поверхность Ферми по экспериментальным данным.
У одновалентных (щелочных) металлов поверхность Ферми имеет форму сферы (рис.86). У двухвалентных, например, бериллий Ве, поверхность Ферми имеет более сложную форму. Дело в том, что 2 s -уровень в атоме бериллия заполнен полностью. При объединении атомов Ве в кристалл в валентной зоне не образуется вакансий, все уровни по-прежнему заняты. Но при объединении атомов Ве в кристалл следующая 3 s -зона уширяется настолько, что “наезжает” на 2 s -зону. В результате у электронов появляется возможность переходить при тепловом возбуждении в 3 s -зону, превращая ее в зону проводимости.
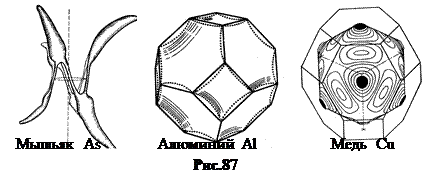
На рис.87 показаны поверхности Ферми для некоторых металлов.
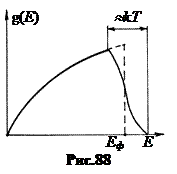
С ростом температуры кривая распределения электронов по энергиям смазывается на графике g (Е) вправо (рис.88), а поверхность Ферми разрыхляется тем сильнее, чем выше температура. При этом распределение электронов приближается к классическому. Критерием поведения любого газа является температура вырождения Т 0 = 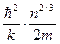 , 12.3)
, 12.3)
При Т < Т 0 газ называется вырожденным, его поведение описывается законами квантовой механики. Например, для электронов проводимости в металлах n» 1029 м-3, m» 10-30 кг. Отсюда, температура вырождения электронного газа Т 0 = 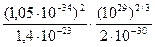 = 8,5·103 К. Следовательно, при всех температурах существования кристаллических проводников электроны проводимости в металлах представляют собой вырожденный газ (Ферми - газ), подчиняющийся квантовым законам.
= 8,5·103 К. Следовательно, при всех температурах существования кристаллических проводников электроны проводимости в металлах представляют собой вырожденный газ (Ферми - газ), подчиняющийся квантовым законам.
Если Т > Т 0, то газ невырожден, по своим свойствам он приближается к классическому. Например, у гелия He m = 6,7·10-27 кг, при нормальных условиях n = 2,7·1025 м-3. Отсюда
Т 0 = 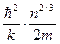 =
=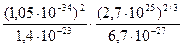 »0,01 К.
»0,01 К.
Примененный здесь критерий температуры вырождения Т 0 не учитывает возможность фазовых переходов в реальных газах. Он лишь определяет температурную границу использования квантовой или классической статистик для описания конкретной системы частиц.
5. Парадокс теплоемкости металлов. Как известно из курса молекулярной физики, для твердых кристаллических диэлектриков справедлив закон Дюлонга и Пти ( 1819 г.), согласно которому молярная теплоемкость всех твердых кристаллических веществ одинакова для всех веществ, практически не зависит от температуры и равна 3 R.
Классическая теория так объясняет этот опытный закон. Каждый атом – узел кристаллической решетки можно уподобить упругому осциллятору, способному колебаться в 3-х взаимно перпендикулярных направлениях. Полагая осцилляторы гармоническими с непрерывно изменяющейся энергией, можно постулировать, что на каждое направление приходиться в среднем kTç 2 кинетической и kTç 2 потенциальной энергии осциллятора. Средняя энергия осциллятора составляет в этом случае 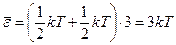 . (12.4)
. (12.4)
Один моль содержит число Авогадро NA атомов. Внутренняя энергия одного моля U= 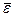 NA =3 kNA·T= 3 RT. Изохорная молярная теплоемкость
NA =3 kNA·T= 3 RT. Изохорная молярная теплоемкость 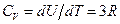 . (12.5)
. (12.5)
Сложнее оказалось объяснить теплоемкость металлов. В начале 20 века еще в доквантовую эпоху Друде и Лоренц построили электронную теорию проводимости металлов. В основу теории было положено предположение, что валентные электроны атомов металлов связаны со своими атомами настолько слабо, что могут легко перемещаться от одного атома к другому лишь за счет энергии теплового движения. Такую совокупность обобществленных валентных электронов они рассматривали как идеальный газ, подчиняющийся распределению Максвелла – Больцмана (см. Электричество, §9).
Теория Друде – Лоренца просто и наглядно объяснила эмпирические законы Ома и Джоуля – Ленца. Но она оказалась не в состоянии объяснить закон Дюлонга и Пти у металлов. Действительно, если в объеме кристалла наряду с атомами – узлами есть электронный газ, то теплоемкость кристалла должна складываться из теплоемкости этих двух систем частиц, находящихся в тепловом равновесии.

Пусть на каждый атом приходиться Z валентных электронов. Тогда на 1 моль узлов приходится Z молей электронного газа. Молярная теплоемкость узлов – осцилляторов равна 3 R, теплоемкость Z молей идеального газа равна (3 Rç 2)· Z. Суммарная теплоемкость CV = 3 R + 3 ZRç 2. При Z = 1 CV = 4,5 R. У натрия, калия, лития и других одновалентных металлов молярная теплоемкость должна быть 1,5 раза больше, чем постулирует закон Дюлонга и Пти. Но опыт показывает, что CV металлов, как и диэлектриков, ближе к 3 R. В этом суть парадокса теплоемкости.
Квантовая теория объясняет этот парадокс. Средняя энергия электронов на заполненных уровнях зоны проводимости составляет около 3 эВ = 4,8·10-19 Дж. Средняя энергия теплового движения при комнатной температуре kT» 1 ç 40 Эв. Поэтому тепловой энергии недостаточно для перевода всех электронов на верхние свободные уровни.
Вклад в теплоемкость вносят лишь самые верхние электроны проводимости вблизи поверхности Ферми, которые имеют сверху свободные энергетические уровни с относительно малой шириной энергетического перехода (рис.89). Поэтому-то вклад электронов в теплоемкость кристаллической решетки мал и составляет всего около 1%.
 2014-02-02
2014-02-02 12696
12696
