Электроны атома движутся в центральном электрическом поле и могут обладать как нулевым, так и ненулевым угловым моментом, причём угловой момент и его проекция квантуются. Но правилам (7) и (8). Кроме того, энергия электрона определяется квантовым числом n, причём можно показать, что n > 1. Итак имеются три квантовых числа, описывающих состояние электрона в атоме:
n – главное квантовое число, n = 1,2,3,…
l – орбитальное квантовое число, l = 0,1,2,…n-1
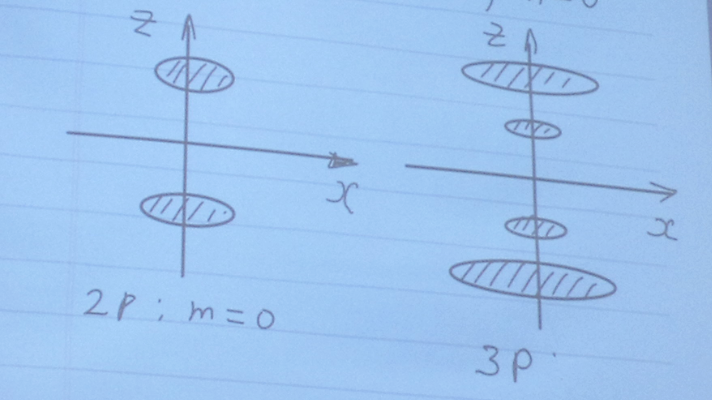
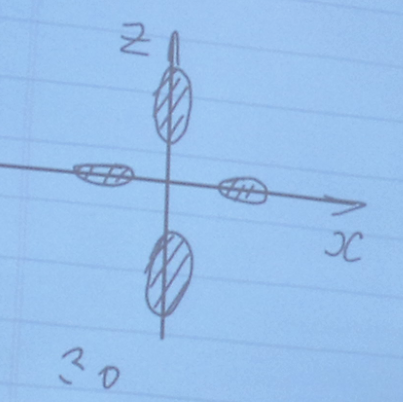
m – магнитное квантовое число, m = 0,+-1,+-2,…+-l
Главное квантовое число определяет энергию уровней:
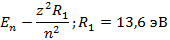
Магнитное квантовое число определяет проекцию углового момента на ось OZ:
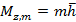
Если теперь учесть, что при каждом l‚ электрон может находиться в состояниях с (2l +l) значениями m, то число состояния с разными l и m на уровне, характеризуемом главным квантовым числом n, равно:
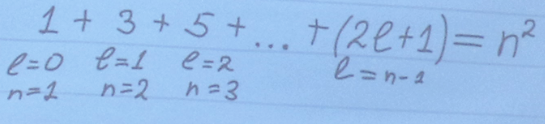
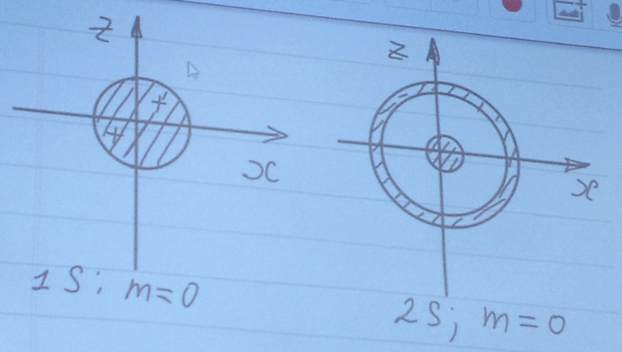
В атомной физике применяются заимствованные из спектроскопии условные обозначения состояний электрона с различным значением момента импульса.
l = 0 S – состояние;
l = 1 P – состояние;
l = 2 d – состояние;
l = 3 f – состояние.
Итак, в атоме водорода возможны следующие состояния:
 2015-04-20
2015-04-20 2186
2186
