Содержание углерода в металлургических средах (газовой, шлаковой и металлической) существенно влияет на состав и свойства этих фаз, особенно газовой.
Из возможных взаимодействий углерода с окислителями рассмотрим наиболее важные.
1. Реакция неполного сгорания углерода
2С + О2 = 2СО, DG°Т(2.1) = - 221 120 - 180Т Дж/моль. (2.1)
2. Реакция полного сгорания
С + О2 = СО2, DG°Т(2.2) = - 393 260 - 2,3Т Дж/моль. (2.2)
3. Реакция газификации углерода паром Н2О до СО
2С + 2Н2О = 2СО + 2Н2, DG°Т(2.3) = 271 080 - 288Т Дж/моль. (2.3)
4. Реакция газификации углерода паром Н2О до СО2
С + 2Н2О = СО2 + 2Н2, DG°Т(2.4) = 98 960 - 110,6Т Дж/моль. (2.4)
5. Реакция газификации углерода
С + СО2 = 2СО, DG°Т(2.5) = 172 140 - 177,7Т Дж/моль. (2.5)
Наибольший интерес представляет реакция (2.5), являющаяся эндотермической: DН°298 (2.5) = 172,6 кДж.
По отношению 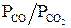 , которое устанавливается реакцией газификации углерода, можно судить о влиянии твердого углерода на состав газовой фазы системы С - СО - СО2 в широком температурном интервале. Равновесный состав этой газовой атмосферы представлен на рис. 2.1.
, которое устанавливается реакцией газификации углерода, можно судить о влиянии твердого углерода на состав газовой фазы системы С - СО - СО2 в широком температурном интервале. Равновесный состав этой газовой атмосферы представлен на рис. 2.1.
Согласно принципу Ле Шателье повышение давления смещает равновесие реакции газификации углерода влево, то есть при неизменной температуре равновесная газовая смесь обогащается двуокисью СО2. При понижении давления концентрация СО в газовой фазе увеличивается.
Гетерогенный процесс взаимодействия углерода с окислителем состоит из ряда стадий:
1) турбулентная диффузия окислителя в газовом потоке к поверхности раздела фаз;
2) молекулярная диффузия через гидродинамический слой толщиной dГ, где сохраняется ламинарное течение;
3) адсорбция окислителя на поверхности углерода;
4) химическое взаимодействие с образованием адсорбированных продуктов (СО2 при низких температурах и СО при высоких);
5) десорбция продуктов реакции;
6) диффузия (молекулярная и турбулентная) продуктов реакции в газовый поток.
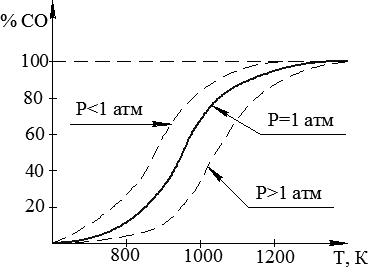
Рис. 2.1. Состав газовой атмосферы (СО - СО2) в равновесии с твердым углеродом
Лимитирующей в процессе окисления углерода является адсорбционно-кинетическая стадия, объединяющая в себе стадии 3, 4 и 5. Лимитирующей может быть и молекулярная диффузия.
Скорость диффузии в расчете на единицу поверхности можно рассчитать по формуле
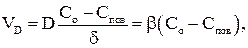 (2.6)
(2.6)
где D – коэффициент диффузии, b – коэффициент массопереноса, Со и Спов – концентрация окислителя в объеме газовой фазы и на поверхности углерода, соответственно.
Скорость химического взаимодействия определяется концентрацией адсорбированного реагента Спов:
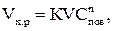 (2.7)
(2.7)
где К – константа скорости реакции, зависящая экспоненциально от температуры энергии активации процесса, n – порядок реакции (в данном случае n = 1).
Если процесс взаимодействия углерода с газовой фазой происходит в стационарном режиме, т.е. без изменения скорости во времени, то скорость этого процесса Vпроц определяется как
Vпроц = V х.р = VD. (2.8)
Подставляя в (2.8) соотношения (2.6) и (2.7), в итоге получаем наблюдаемую скорость процесса окисления углерода:
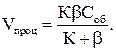 (2.9)
(2.9)
В зависимости от соотношения величин К и b возможны следующие режимы окисления:
– кинетический при b >>K;
– диффузионный при К>>b;
– диффузионно-кинетический при К» b.
Термодинамический анализ реакции (2.5) позволяет выявить условия распада монооксида углерода. Это возможно в газовых атмосферах с большим отношением 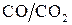 и при понижении температуры. Величина DG°Т для реакции
и при понижении температуры. Величина DG°Т для реакции
2СО = СО2 + С
уменьшается с понижением температуры, но кинетически без катализатора осуществить данную реакцию, используемую, например, в процессе цементации, затруднительно.
Для окисления связи «С - О» в молекуле СО нужна каталитическая твердая поверхность, наиболее сильным катализатором является железо. При этом основными стадиями процесса распада СО с образованием твердого мелкодисперсного углерода будут следующие:
1) адсорбция молекулы СО на поверхности катализатора, приводящая к ослаблению связи «С - О»;
2) процесс распада при ударе активной молекулы СО газовой фазы об адсорбированную по реакции
СО + Соадс = СО2 + С.
 2015-05-05
2015-05-05 1641
1641
