Терапия различных болезней системы пищеварения может быть этиотропной, патогенетической (заместительной, стимулирующей, тормозной, корригирующей), саногенетической и симптоматической.
Лечение хронического гиперацидного гастрита типа Б включает: 1) соответствующую щадящую диету, 2) средства, подавляющие размножение Helicobacter pylori (де-нол, трихопол, метронидазол и др.) и других микроорганизмов (фуразолидон, полусинтетические пенициллины и др.), 3) лекарства, снижающие кислотность желудочного сока (антациды, антихолинергические средства), 4) обволакивающие и вяжущие средства, 5) поливитамины, 6) полиферментные препараты (фестал, дигестал и др.), 7) санаторно-курортное лечение (вне обострения заболевания).
Лечение хронического гипоацидного гастрита включает: 1) соответствующую диету, 2) стимулирующие и заместительные средства (желудочный сок, абомин, ацидин-пепсин и др.), 3) активирующие трофические процессы лекарства (солкосерил и др.), 4) противовоспалительные препараты (настойки прополиса, календулы, ромашки, цикория и др.), 5) иммуномодуляторы (тимоген, тактивин, левамизол), 6) адаптогены (настойки женьшеня, левзеи, экстракты элеутерококка, родиолы розовой и др.).
Лечение язвенной болезни желудка и двенадцатиперстной кишки должно быть комплексным, своевременным, способным быстро купировать обостение и эффективно уменьшать число и выраженность рецидивов заболевания. Оно прежде всего должно обеспечить подавление кислотно-пептической и хеликобактерной агрессии и повысить защитные возможности гастродуаденальной слизистой. Для этого используются: 1) диетическое питание, 2) средства, снижающие агрессивные свойства желудочного сока, достигаемого использованием Н2-гистаминовых рецепторов (циметидин, ранитидин, низатидин), М-холиноблокаторов (атропин, метацин и др.), антацидов (маалокс, ремагель, альмагель, фосфалюгель, алюминия гидроокись и др.), 3) средства, подавляющие размножение Helicobacter pylori и способствующие их элиминации из организма (омепразол, лосек, ранитидин, фамотидин, клацид, ампиокс и др.) 4) средства, повышающие защитные свойства слизистых оболочек желудка и двенадцатиперстной кишки (де-нол, висмута нитрат основной, фосфалюгель, сукралфат и др.) и т.д.
Лечение хронического панкреатита направленно на ослабление и устранение: 1) воспаления железы и поддерживающих его факторов; 2) болевого синдрома (используя анальгетики ненаркотические и наркотические, спазмолитики, холинолитики, местные анестетики); 3) нарушений внешней и внутренней секреции желудочных желез (назначая антациды, дробное щадящее питание, ингибиторы протеаз, гепарин, липотропные средства, ферментные препараты и др.); 4) повышенных катаболических процессов в организме (применяя анаболики и ряд белковых препаратов); 5) гиповолемии (используя солевые растворы, плазмозаменители, альбумин, плазму, раствор новокаина); 6) недостаточности кровообращения (применяя сердечные и сосудистые препараты: сердечные гликозиды, адреномиметики и др.); 7) отечного синдрома (назначая диуретики: маннитол, эуфиллин и др.).
Лечение хронического энтерита включает: 1) соответствующее диетическое дробное питание; 2) поливитамины; 3) переливание плазмы, плазмозамещающих растворов, иногда крови; 4) белковые препараты (энтерально - белковые гидролизаты, парентерально – смеси аминокислот); 5) гепатопротекторы (силибор, легалон, ЛИВ-52 и др.); 6) препараты железа для уменьшении анемии (ферроплекс, гемостимулин и др.); 7) средства, нормализующие расстройства водно-солевого обмена (внутривенно панангин, кальция глюконат, натрия хлорид); 8) препараты, снижающие метаболический ацидоз (натрия гидрокарбонат, панангин и др.); 9) препараты, снижающие метаболический алкалоз (калия хлорид, кальция хлорид, магния сульфат и др.); 10) средства, купирующие диарею (кальция карбонат, белая глина, препараты алюминия, висмута, танина, альбумина, лоперамида и др.); 11) заместительные ферментные препараты (мезим форте, дигестал, фестал, триаза и др.); 12) средства, нормализующие нарушенную моторику кишок (холинолитики, спазмолитики и др.); 13) антибактериальные препараты; 14) пробиотики и препараты адсорбирующего действия (для уменьшения и ликвидации дисбактериоза).
Лечение хронического колита является комплексным, достаточно сложным и, к сожалению, не всегда эффективным. Оно включает: 1) соответсвтующее диетическое дробное питание (диета № 4); 2) средства, ослабляющие и ликвидирующие дисбактериоз (бифидумбактерин, колибактерин, лактобактерин и др.); 3) заместительные полиферментные препараты (креон, фестал, панзинорм и др.); 4) средства, нормализующие нарушенную моторику кишок - холинолитики (атропин, метацин, реасек), спазмолитики (но-шпа, папаверин, галидор); 5) препараты, купирующие диарею (кальция карбонат, белая глина, препараты алюминия, висмута, танина, альбумина, лоперамида и др.); 6) средства, активизирующие репаративные процессы – анаболические стероиды (метандро- стенолол, ретаболил, силаболин); 7) средства, повышающие устойчивость к гипоксии – антигипоксанты (гутимин, олифен); 8) средства, оказывающие антирадикальное и антиперикисное действие – антиоксиданты (токоферола ацетат, дибунол, мексидол); 9) средства, стимулирующие процессы иммунитета (тактивин, миелопид, тимоген, левамизол, продигиозан); 10) средства системной энзимотерапии (вобэнзим, флогэнзим), обладающие сочетанными противовоспали тельными, иммуномоделирующими, улучшающими реологические свойства крови, эндотелиопротекторными и антиоксидантными эффектами.
ГЛАВА 34. ПАТОЛОГИЯ ПЕЧЕНИ
Патология печени включает разнообразные клинические формы и синдромы, характеризующиеся снижением основных её гомеостатических как пищеварительных, так и не пищеварительных функций.
При патологии печени могут нарушаться практически все виды обмена веществ (белков, ферментов, липидов, углеводов, гормонов, пигментов, витаминов, воды), процессы детоксикации, количество циркулирующей крови и ее состав, активность свёртывающей и антисвёртывающей систем крови, желчеобразование, желчевыделение, переваривание в тонких кишках пищи, особенно липидов, моторика всего кишечника, а также различных как исполнительных, так и регуляторных систем.
34.1. МОРФО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ПЕЧЕНИ
Строение печени. Морфо-функциональной единицей печени, как известно, является печеночная долька, которая имеет форму призмы (рисунок 34-1). Между дольками имеется незначительное количество соединительной ткани, в которой располагаются междольковые желчные протоки, ветви печеночной артерии и воротные вены, лимфатические сосуды и нервные волокна. В центре каждой дольки находится центральная венула, к которой по синусоидным капиллярам движется кровь. Между каждыми двумя терминальными печеночными венулами («центральными венами») располагаются печеночные ацинусы (рис. 34-2). Ацинусы делятся на три зоны (1-внутренняя, 2- промежуточная, 3- наружная). Ацинусы рассматриваются не только как микроциркуляторная, но и как секреторная единица печени. Последняя включает желчные протоки, наибольший диаметр которых определяется в зоне 1, а наименьший – в зоне 3.
Ведущими клетками как по количеству (65%), так и по объему (80%) являются гепатоциты. Кроме них в печени находятся эндотелиоциты, клетки Купфера, лимфоциты, особенно, Т-лимфоциты (портальные – 90% и синусоидальные – 10%) и NK-клетки (участвующие в формировании клеточного специфического и неспецифического иммунитета), клетки соединительной ткани (формирующие каркас органа), нервные волокна и др.
Кровоснабжение печени. Печень удивительно хорошо кровоснабжается (в норме через нее за сутки проходит около 2000 л крови). Печень 80% крови получает из воротной вены и 20% из печеночной артерии, которые входят в орган через ворота. Внутри печени эти сосуды делятся, образуя большое количество синусоидов, еще большее количество междольковых и внутридольковых сосудов, но, особенно, синусоидальных капилляров. Общая поверхность последних достигает 400 м2 . Капилляры образуют центральные внутридольковые венулы, которые в свою очередь формируют собирательные венозные сосуды, а они – печеночные вены, которые впадают в нижнюю полую вену.
Лимфатическая система печени представлена глубокими и поверхностными лимфатическими сплетениями. Первые располагаются параллельно ветвям портальных и печеночных вен. Вторые находятся в капсуле. Между этими сплетениями имеется множество анастомозов. Из поверхностных лимфатических сосудов образуется 14 групп лимфатических стволов, которые дренируют до 80% печеночной лимфы. В норме за одни сутки в печени образуется около 1-3 л лимфы, что обеспечивает устойчивое поддержание постоянства ОЦК.
Регуляция различных структур, метаболических процессов и функций печени осуществляется с участием вегетативной нервной системой (ее симпатического, парасимпатического и метасимпатического отделов), а также различных ФАВ. Вегетативные нервные волокна входят в печень в виде передних и задних стволов, а также в составе стенок сосудов и связок. Печеночные артеральные сосуды иннервируются преимущественно симпатическими волокнами, вены и желчные протоки – и симпатическими, и парасимпатическими волокнами. В регуляции многообразной деятельности печени важное место занимают как основные медиаторы (НА и АХ), так и другие медиаторы и ФАВ (серотонин, АТФ, ВИП, нейропептид Y, нейротензин, глюкагон, соматостатин, простагландины, оксида азот и др.).
34.2. ОСОБЕННОСТИ ПАТОЛОГИИ ПЕЧЕНИ
Отличительными особенностями патологии печени являются следующие:
- любые, даже локальные, патологические изменения данного органа обязательно характеризуются системными проявлениями (приспособительного и разрушительного, морфологического и функционального, специфического и неспецифического характера);
- данный жизненно важный орган отличается уникальной способностью к физиологической и репаративной регенерации гепатоцитов, эндотелиальных клеток и соединительной ткани (в норме соответственно составляющих 60 %, 20 % и 20 % от всей массы органа);
- печень удивительно хорошо кровоснабжается (в норме через печень за сутки проходит около 2000 л крови, поступающей в 80 % по системе воротной вены и в 20 % по печёночной артерии и проходящей через огромное число синусоидов и ещё большее количество капилляров; общая поверхность только капилляров печени достигает 400 м2);
- при чрезмерно большом остром или медленно прогрессирующем хроническом воспалительном и/или дистрофическом повреждении паренхимы печени снижаются и извращаются многочисленные метаболические, структурные и физиологические гомеостатические процессы и нарастают явления фиброза органа.
34.3. ЭТИОЛОГИЯ
Патологию печени вызывают разнообразные этиологические факторы и неблагоприятные внутренние и внешние условия. Среди причинных факторов наибольшее значение имеют различные биологические и химические повреждающие воздействия (РНК- и ДНК-содержащие вирусы, бактерии: стрептококки, стафилококки, сальмонеллы, палочки Коха и др.; паразиты: эхинококки, амёбы, лямблии и др.; лекарственные препараты: вакцины, чужеродные белки, барбитураты, аминазин, антибиотики, сульфаниламиды, особенно при длительном их применении и др.; промышленные органические и неорганические гепатотропные яды: четырёххлористый углерод, хлороформ, гексохлоран, бензол, фосфор, свинец, ртуть и др.); - расстройства общей и местной гемодинамики; - количественно и качественно неполноценное питание (недостаток углеводов, липидов, белков, особенно незаменимых аминокислот, ненасыщенных жирных кислот, а также витаминов, макро- и микроэлементов, ФАВ, воды и др.; - избыток как животных жиров и углеводов, особенно алкоголя и его суррогатов); недоброкачественная пища; - опухоли (особенно злокачественные); - травмы и др. Патогенные факторы могут действовать не только прямо на те или иные клеточные и внеклеточные структуры, ответственные за обеспечение многообразных метаболических процессов, а также крово- и лимфообращенияв печени, но и опосредованно через изменение исполнительных (кровообращение, дыхание, пищеварение, выделение и др.) и регуляторных (нервной, эндокринной, гуморальной, иммунной и генетической) систем.
34.4. Классификация основных видов патологии печени
Расстройства многофункциональной деятельности печени могут быть:
* первичными или наследственными и вторичными или приобретенными (по происхождению),
* очаговыми и диффузными (по объему повреждения),
* острыми и хроническим (по клиническому течению),
* компенсированными и некомпенсированными (по степени компенсации нарушенных функций),
* лёгкими, средними, тяжёлыми (по тяжести патологии),
* в виде сниженной, повышенной и извращённой функции (по направленности нарушений той или иной функции),
* обратимыми и необратимыми (по степени обратимости той или иной па тологии печени),
* в виде преимущественно повреждения либо гепатоцитов, либо эндотелиоцитов, либо соединительной ткани, либо сочетанными (по нарушению основных структурных элементов печени),
* преимущественно в виде воспаления, дистрофии, холестаза, цитолиза, печеночно-клеточной недостаточности и смешанными (по характеру патологического процесса в печени),
* обусловленные преимущественным нарушением обмена белков, ферментов,липидов, углеводов, гормонов, витаминов, ФАВ; желчных пигментов; желчеобразования и желчевыделения; обезвреживания токсических веществ; фагоцитарной активности купферовских клеток, печеночных макрофагов и эндотелиоцитов, депонирования крови и др. (в зависимости от выраженности нарушений тех или иных гомеостатических функций),
· в виде портальной гипертензии, асцита, гепатолиенального синдрома, желтух, печеночной комы (по выраженности ведущего патофизиологического синдрома).
34.5. Краткая характеристика основных клинико-
биохимических синдромов при патологии печени
В зависимости от характера патологического процесса в печени и использования различных лабораторных методов исследования выделяют следующие основные клинико-биохимические синдромы.
Воспалительный синдром. Возникает при воспалении перилобулярных желчных ходов (холангиолитах) и междольковых желчных протоков (холангитах), а также кровеносных сосудов, желчных канальцев, гепатоцитов, эндотелиоцитов и соединительно-тканных структур. Важное место в его развитии занимает сенсибилизация иммунокомпетентных образований и активация макрофагально-гистиоцитарной системы. Синдром характеризуется повышением в сыворотке крови содержания g-глобулинов, особенно IgG, IgM и IgA, иногда гиперпротеинемией, появлением различных неспецифических антител и положительных белково-осадочных проб (тимоловой, сулемовой, формоловой).
Дистрофический синдром. Возникает обычно при отравлениях недоброкачественными пищевыми продуктами, грибами, гепатотропными промышленными ядами, вирусами, инсектицидами, длительным приемом в больших дозах алкоголя, лекарств, а также при избытке в пище жиров и углеводов и недостатке в ней минеральных веществ, белков и кислорода. В патогенезе важное место занимает иммунопатологические, аллергические и аутоаллергические процессы. Токсическая дистрофия обычно переходит в прогрессирующий цирроз и некроз паренхиматозных структур печени и заканчивается гибелью больного.
Синдром холестаза. Обусловлен нарушением процесса желчевыделения. Различают внутрипеченочный и внепеченочный холестаз. Первый обусловлен нарушением образования желчной мицеллы и поражением мельчайших желчных ходов. Второй связан с нарушением оттока нормальной желчи в результате механических препятствий во внепеченочных желчных путях. Обе формы холестаза сопровождаются повышением в крови: 1) активности экскреторных ферментов (щелочной фосфатазы, g-глютамилтранспептидазы, 5'-нуклеотидазы, b-глюкуронидазы), 2) содержания холестерина, фосфолипидов, желчных кислот, 3) уровня билирубина (особенно его конгъюгированной формы).
Синдром цитолиза. Обусловлен нарушением целостности гепатоцитов, повышением проницаемости мембран клеток и их органелл. Возникает при острых и хронических повреждениях печени гепатотропными вирусами, токсическими веществами, лекарствами и др. В патогенезе деструкции гепатоцитов и их мембран важное значение имеют активация лизосомальных гидролаз, расстройства окислительных процессов, дефицит кислорода, избыток свободных радикалов и перекисей, флогогенных факторов, аутоантител, сенсибилизированных Т-лимфоцитов, острый недостаток энергетических веществ и нарушение синтеза белков. Синдром характеризуется повышением в крови активности индикаторных ферментов (аспартат- и аланинаминотрансферазы, лактадегидрогеназы, альдолазы), уровня билирубина (особенно его неконъюгированной формы) и снижение активности секреторных ферментов (холинэстразы, церулоплазмина, проантикоагулянтов).
Синдром печеночноклеточной недостаточности. Его основу составляет прогрессирующее снижение синтетических функций печени. Возникает под влиянием различных гепатотропных повреждающих факторов. Может быть следствием любого рассмотренного выше синдрома (воспалительного, дистрофического, холестатического, цитолитического) или их сочетания. Для данного синдрома характерно снижение в сыворотке крови общего белка и альбуминов, I, II, V, VII, VIII, IХ, Х, ХI, факторов свертывания крови, холестерина, фосфолипидов, желчных кислот, активности секреторных ферментов и повышение уровня билирубина (особенно его неконъюгированной формы).
34.6. Печеночная недостаточность
Под функциональной недостаточностью печени понимают расстройства одной, нескольких или многих ее функций, сопровождающихся временными, стойкими или прогрессирующими теми или иными нарушениями гомеостаза
Различают следующие основные виды недостаточности печени:
· наследственная и приобретённая,
· парциальная, субтотальная и тотальная,
· сверх острая (менее 7 дней), острая (от 8 до 28 дней), подострая (от 4 до 12 недель) и хроническая (свыше 3 месяцев),
· компенсированная (обратимая) и некомпенсированная (необратимая),
· не летальная и летальная,
· внутрипечёночная и внепечёночная,
· без развития энцефалопатии (сопровождается потерей аппетита, общим недомоганием, усталостью, снижением работоспособности) и с развитием энцефалопатии (характерны головные боли, сонливость, расстройство рефлекторной регуляции жизненных функций, развитие печёночной комы).
Под острой печеночной недостаточностью (ОПН) обычно понимают быстро развивающееся снижение синтетической функции печени, сочетающееся с выраженной коагулопатией (снижение протромбинового индекса и уровня фактора V более чем на 50 % от нормы), а при тяжелой ее форме - и печеночной энцефалопатией.
К развитию ОПН чаще приводят вирусные и лекарственные гепатиты.
В частности, ОПН в 8 % случаев возникает под действием вируса гепатита А, в 3 – 47 % случаев – под влиянием вируса гепатита В, еще чаще - при их сочетании с вирусами гепатита Д и Е, в 2 –56 % случаев - при передозировке ацетоминофена (парацетамола), в 5 – 18 % случаев - при действии других лекарств и токсинов (особенно грибов типа Amanita galerina) и т.д.
ОПН может осложняться печеночной энцефалопатией, отеком мозга, острой легочной недостаточностью, коагулопатией, сепсисом, различными метаболическими расстройствами, полиорганной недостаточностью, печеночной комой, децерабрационной комой и приводить без оказания неотложной квалифицированной помощи к гибели больного.
34.6.1. ХАРАКТЕРИСТИКА ОСНОВНЫХ ПРОЯВЛЕНИЙ ПЕЧЁНОЧНОЙ НЕДОСТАТОЧНОСТИ
Расстройства обмена белков проявляются нарушением синтеза различных аминокислот, глобулинов (главным образом, g - глобулина – основного поставщика антител) и, особенно, альбуминов, комплексных соединений: гликопротеидов, липопротеидов, церулоплазмина, трансферина, мочевины (из аминогрупп и аммиака); прокоагулянтов (фибриногена, протромбина, глобулина акцелератора, проконвертина) и антикоагулянтов; катаболизма аминокислот, белков и их комплексов; процессов дезаминирования, переаминирования и декарбоксилирования аминокислот. При повреждениях печени в крови чаще всего отмечается увеличение содержания и нарушение соотношения аминокислот (фенилаланина, тирозина, триптофана, метионина и др.), снижение альбуминов, a-липопротеидов (ЛПВП), гликопротеидов, мочевины и увеличение g-глобулинов, b-липопротеидов (ЛПНП и ЛПОНП), аммиака и т.д. В итоге развиваются не только дис-, но и гипопротеинемия, приводящая к снижению онкотического давления крови и развитию отеков.
Расстройства обмена ферментов возникают при патологии, главным образом, рибосом, а также эндоплазматического ретикулума, митохондрий, гладкого ретикулума и др. органелл гепатоцитов. При белковой патологии в печени всегда развиваются ферментопатии (так как около 50 % белка идет на синтез ферментов). Проявляется изменением количества и активности органо-
специфических (секреторных, индикаторных, экскреторных), а также клеточноспецифических (АТФ-фазы, 5-нуклеотидазы и др.) и органеллоспецифических (глутаматдегидрогеназы и др.) ферментов. При повреждении гепатоцитов в крови отмечается снижение секреторных и увеличение индикаторных ферментов.
Расстройства липидного обмена проявляются нарушениями:
· синтеза простых и сложных липидов: холестерина (свободного и эстерифицированного), желчных кислот (холевой и хенодезоксихолевой), липопротеидов (a-, b-, преb-), фосфолипидов;
· комплексообразования жирных кислот с желчными кислотами в просвете тонкой кишки, способствующего улучшению их всасывания в лимфу и, частично, в кровь;
· катаболизма токсичных жирных кислот в печени, способствующего повреждению органов, особенно, головного мозга. Эти нарушения способствуют жировой инфильтрации, дистрофии, фиброзу и циррозу печени, возникновению и прогрессированию атеросклероза, ИБС с ее различными клиническими формами, энцефалопатии, камнеобразования, главным образом, в печени и почках, гиперкетонемии и кетонурии и т.д.
Расстройства углеводного обмена проявляются изменениями:
* синтеза глюкозы (из лактата, пирувата, некоторых аминокислот);
* образования глюкозы (из галактозы), фруктозы и, особенно, гликогена (печени, скелетных мышц, сердца и мозга);
* синтеза из глюкозы дисахаридов и гликогена;
* синтеза из различных сахаров гликолипидов и гликопротеидов;
* распада гликогена и дисахаридов до глюкозы, фруктозы и галактозы;
* промежуточного обмена моносахаридов (проявляющимися увеличением в крови и тканях лактата, пирувата и развитием метаболического ацидоза);
* конечного распада сахаров до СО2 и Н2О;
* аэробного и анаэробного синтеза макроэргов (АТФ, АДФ, КРФ).
Печеночная недостаточность характеризуется неустойчивым уровнем глюкозы в крови (после приема пищи развивается гипергликемия, натощак – гипогликемия), а также нарушениями энергетического и пластического обменов в организме и, особенно, в печени.
Расстройства обмена витаминов могут сопровождаться развитием эндогенных гипо- и авитаминозов (как водорастворимых: С, В1, В2, В12, фолиевой кислоты, РР, так и жирорастворимых: А, Д, Е, К), а значит - ферментопатий и нарушений различных процессов метаболизма. Эндогенный недостаток витаминов обусловлен, главным образом, снижением их всасывания из кишечника в кровь и лимфу, нарушением их депонирования в печени, угнетением печеночных ферментов, ответственных за превращение провитамина в витамин (например, каротина - в витамин А в результате угнетения каротиназы). В то же время может тормозиться образование из витаминов коферментов (например, из витамина В1 – кокарбоксилазы, из пирувата или из пантотеновой кислоты - ацетилкоэнзима А и т.д.).
Расстройства обмена гормонов (тканевых и истинных) в печени может приводить к нарушениям в ней синтеза гепарина (а значит изменению процесса свертывания крови), тирозина (а значит образованию адреналина, норадреналина, дофамина), транскортина (белка, специфически связывающего кортикостероиды и приводящего к обратимой их инактивации), биотрансформации гормонов, главным образом, метаболизма кортизола в кортизон и обратно (приводящего к изменению биологической их активности), полной инактивации (устранению биологической активности) глюкокортикоидных, минералокортикоидных и половых гормонов, а также инсулина, тироксина, АДГ и др.
Расстройства пигментного обмена проявляются нарушениями метаболизма билирубина в печени. В условиях патологии печени могут нарушаться (повышаться или снижаться):
· распад гемсодержащих веществ (протопорфирина гемоглобина эритроцитов, метгемоглобина, цитохромов);
· образование либо вердогемоглобина, либо биливердина, либо, наконец, билирубина;
· связывание билирубина с альбуминами крови (токсичного, водо-нерастворимого и не способного проходить через почечный фильтр и именуемого “свободным”, “непрямым”, “неконъюгированным”);
· отщепление белка от билирубина и соединение его с глюкуроновой кислотой с образованием моно- и диглюкуронидов билирубина (нетоксичного, водорастворимого и способного проходить через стенки сосудов и именуемого “связанным”, “прямым”, “конъюгированным”).
Особенности расстройств пигментного обмена определяют вид развившейся желтухи (надпеченочной, печеночной и подпечёночной, см. ниже).
Образование желчных камней (холелитиаз – от греч. chole – желчь и litos – камень) происходит из-за нарушений в печени обмена холестерина, кальция, фосфатов, билирубина, желчных кислот и увеличения их содержания в желчи, а также снижения в ней халатов. При уменьшении халато-холестеринового индекса ниже 14 вероятность образования желчных камней резко повышается. Камнеобразованию также способствует ацидоз желчи (особенно при рН менее 5), увеличение слизи (муцина) и бактерий в желчи, а также застой и сгущение желчи.
Расстройства желчеобразования в печени проявляются изменениями (повышением, снижением) количества и состава желчи. Возникает в результате нарушения гепатоцитами как синтеза, так и захвата из крови и экскреции в желчевыводящие протоки желчных кислот, пигментов, холестерина, фосфолипидов, слизи, бикарбонатов, фосфатов, кальция. Расстройства как желчеобразования, так и желчевыделения могут приводить к нарушениям моторики кишечника, переваривания в нем жиров, всасывания жирных кислот, желчных кислот, пигментов и жирорастворимых питательных веществ, образованию литогенной желчи, изменениям рН кишечного химуса и состава крови, мочи, кала.
Расстройства антитоксической функции печени проявляются нарушениями способности гепатоцитов обезвреживать различные токсические вещества как экзогенного, так и эндогенного происхождения (микроорганизмы и их токсины, моно-, ди- и полимеры белков, липидов, углеводов, их комплексных соединений, алкоголь, лекарства, гормоны, ФАВ, продукты их метаболизма (аммиак, фенолы, не связанные билирубин, желчные кислоты и мн. др.).
Патогенез этих расстройства печени обусловлен нарушениями:
· связывания токсических веществ с серной кислотой (фенол, крезол, индол, скатол), с глюкуроновой кислотой (билирубин и др.), с гликоколом (желчные кислоты, бензойная кислота), в результате чего образуются нетоксичные парные соединения;
· реакций промежуточного и окончательного обмена: метилирования, ацетилирования, переаминирования, дезаминирования, окисления (сульфаниламиды, холин, аммиак, алкоголь, катехоламины, стероидные гормоны и др.);
· реакций гидролиза (сердечные гликозиды, алкалоиды и др.);
· связывания токсических веществ с белками (гормоны, билирубин, ионы и соли металлов и др.);
· процессов пиноцитоза и фагоцитоза (ответственных за удаление токсических веществ из организма)
· процессов выведения с желчью метаболитов и неизмененных веществ (гормоны, лекарства, соли металлов и др.).
34.7. Основные синдромы при патологии печени
К ним относятся печёночная кома, портальная гипертензия, гепатолиенальный синдром, желтухи и др.
34.7.1. ПЕЧЕНОЧНАЯ КОМА
Печёночная кома (от греч. koma – глубокий сон) является наиболее грозным финальным осложнением печеночной недостаточности. Возникает в результате прогрессирующей интоксикации организма недоокисленными метаболитами углеводов и липидов (лактат, пируват, ацетоновые тела и др.), продуктами распада, особенно гнилостного разложения, белков (аммиак, путресцин, кадаверин, олигопептиды, молекулы средней массы), продуктами обмена аминокислот (индол, скатол, фенол, метионин-сульфоксид, метионин-сульфон и др.), производными фенола (крезол и др.), комплексными соединениями аммиака с глутаминовой и/или a-кетоглутаровой кислотами, 2,3-бутиленгликолем, свободным билирубином, низкомолекулярными жирными кислотами (масляная, валериановая, капроновая), нарастающим метаболическим ацидозом. Все это приводит к прямому повреждению клеточно-тканевых структур различных органов (печени, почек, сердца и, особенно, ЦНС, ее корковых, подкорковых, таламических, гипоталамических, стволовых и спинномозговых центров). Кроме того, токсические факторы могут опосредованно усиливать эти расстройства через генерализованные нарушения энергетического обмена (цикла трикарбоновых кислот, утилизации углеводов и др.), системной и региональной гемодинамики, микроциркуляции, внешнего и внутреннего дыхания, свертывающей, антисвертывающей и фибринолитической систем крови и т.д. У больных возникают разнообразные прогрессирующие нервно-психические нарушения, угнетение условно- и безусловнорефлекторной деятельности жизненных функций, апатия, сонливость, бред, судороги, спутанность и потеря сознания, “печеночный” запах изо рта, завершающиеся гибелью организма.
34.7.2. ПОРТАЛЬНАЯ ГИПЕРТЕНЗИЯ
Портальная гипертензия является серьезным осложнением печеночной недостаточности и ряда заболеваний печени. Характеризуется застоем крови в системе воротной вены и существенным (в 5-7 раз) повышением давления крови в воротной вене (в норме составляющем 10-15 мм рт.ст.). Часто приводит к развитию и прогрессированию асцита (от греч. askites hydrops – брюшная водянка, представляющая скопление транссудата в брюшной полости). В его генезе, кроме повышения давления крови в портальной системе, важное место занимает гипопротеинемия (преимущественно за счет гипоальбуминемии) и задержка натрия (главным образом, за счет вторичного гиперальдостеронизма).
Внутрипечёночная портальная гипертензия развивается в результате цирроза печени, гепатитов, гепатозов, сдавления опухолью ствола воротной вены в месте вхождения ее в ткань печени, тромбоза просвета воротной и селезеночной вен.
Внепечёночная портальная гипертензия обусловлена затруднением оттока крови по печеночным венам (из-за их тромбоза, недостаточности правого желудочка сердца и др.).
Портальная гипертензия приводит к существенному уменьшению крово- и лимфобращения в печени, усиливающемуся в результате формирования портопечёночных анастомозов. Портальная гипертензия обычно сопровождается развитием многообразных метаболических и функциональных расстройств. Всё это проявляется снижением и качественным нарушением различных гомеостатических функций организма (дезинтоксикации, синтеза и распада альбуминов, глобулинов, липидов, углеводов, желчных кислот и пигментов, их комплексных соединений, прокоагулянтов и др.), а также лимфообращения, кровообращения, кроветворения, пищеварения и др.).
34.7.3. ГЕПАТОЛИЕНАЛЬНЫЙ СИНДРОМ
Гепатолиенальный синдром более чем в 90 % случаев является следствием диффузных поражений печени, а также дефектов портальной системы, болезней систем кровообращения и крови, хронических инфекционных и паразитарных заболеваний и т.д. Проявляется существенным увеличением (вплоть до мегалии) печени и селезенки, объединенных системой воротной вены, а также общностью иннервации и лимфооттока. Увеличение этих органов обусловлено: - застоем крови; - гиперплазией лимфоидных, макрофагальных и гистиоцитарных структур; - дистрофией гепатоцитов; - диффузным разрастанием соединительной ткани; развитием цирроза и опухолей печени и селезенки, холестаза, тромбоза, эндофлебита воротной и/или печеночной вен.
34.7.4. ЖЕЛТУХИ
Желтуха (от греч.ikteros – желтуха ) рассматривается как синдром желтушного окрашивания склер, слизистых оболочек и кожи, обусловленной избыточным накоплением в крови билирубина в результате нарушения его обмена (образования, захвата, связывания, выведения).
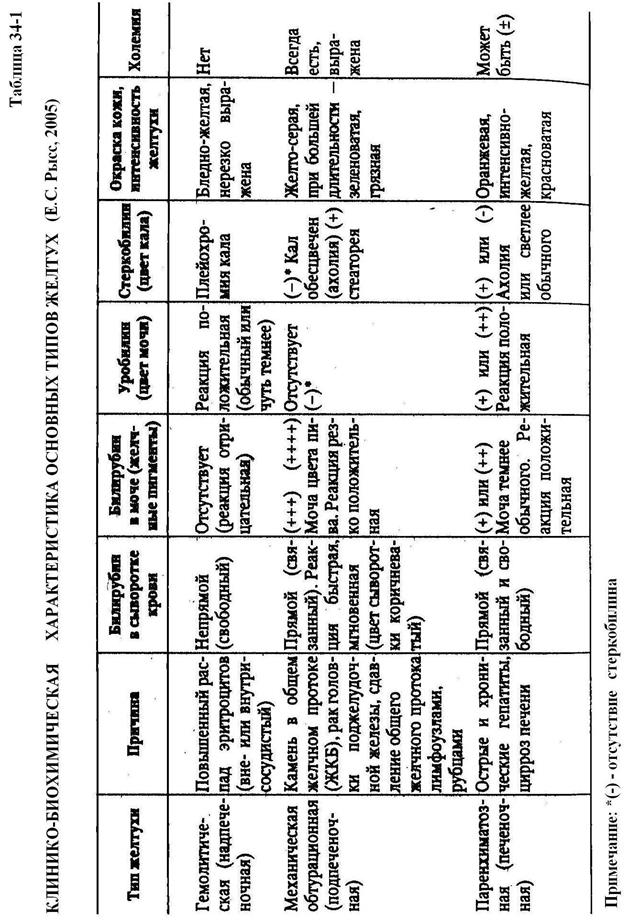
В соответствии с патогенетической классификацией выделяют три основных вида желтух: гемолитическую (пред- или надпеченочную), паренхиматозную (печеночную) и механическую (обтурационную, пост- или подпеченочную).
Основные характерные для них биохимические и клинические показатели представлены в таблице 34-1.
Надпеченочная желтуха возникает в результатеусиленного гемолиза эритроцитов (при переливании несовместимой крови, действии гемолитических ядов, сульфаниламидных препаратов, при развитии лучевой болезни, сепсиса и т.д.). При этом количество высвобождающегося гемоглобина может увеличиваться до 35-45 г (при 6-7 г в норме). Это приводит к резкому увеличению как образования в печени, так и содержания в крови свободного (непрямого, неконьюгированного) билирубина в связи с неспособностью печени переводить его полностью в связанный (прямой, коньюгированный) билирубин. Характерны также резкое увеличение в крови и моче уробилиногена, в кале – стеркобилина и желчных кислот, темный цвет мочи и кала, развитие гиперхромной, гиперрегенераторной анемии и отсутствие увеличения в крови желчных кислот, холестерина, активности аминотрансфераз и щелочной фосфатазы.
Печеночная желтуха возникает в результате изолированного или сочетанного нарушения процесса захвата (из крови), связывания (с глюкуроновой кислотой) и выведения (с желчью прямого и непрямого) билирубина. Она может быть трех видов: паренхиматозной (печеночно-клеточной), энзимопатической и холестатической.
Паренхиматозная желтуха вызывается различными гепатотропными повреждающими факторами (вирусами, бактериями, паразитами, четыреххлористым углеродом, алкоголем, аутоантителами). Сначала повреждаются клеточные и субклеточные мембраны, (повышается их проницаемость), затем – различные органеллы и ферментные системы гепатоцитов, приводящие к развитию разнообразных метаболических нарушений, ослаблению окислительно-восстановительных процессов, снижению, образования и использования макроэргов и усилению нарушений различных гомеостатических функций (уменьшению синтеза белков, липидов, углеводов, образования и выделения желчи и т.д.). На фоне дистрофических нарушений постепенно нарастают деструктивные и некротические процессы в паренхиматозных структурах печени, которые замещаются усиленно образующейся соединительной тканью. Характер и выраженность структурных, метаболических и функциональный нарушений печени зависят от степени альтерации и количества поврежденных гепатоцитов, а также от стадии развития желтухи (схема 34-1).
Для первой (преджелтушной) стадии характерно:
- снижение активности ферментов, разрушающих уробилиноген (это проявляется уробилиногенемией и уробилиногенурией);
- повреждение и повышение проницаемости мембран гепатоцитов (это проявляется развитием гиперферментемией, особенно АЛТ и АСТ, и гиперкалиемией);
- снижение активности глюкуронилтрансферазы (это проявляется снижением образования прямого билирубина, приводящего к уменьшению содержания стеркобилиногена в крови, моче и кале).
Вторая (желтушная) стадия характеризуется:
- усилением повреждения и повышения проницаемости мембран гепатоцитов (что сопровождается гиперферментемией, расстройством, угнетением билирубинового транспорта с помощью лигандина и глюкуронилтрансферазы);
- сдавлением желчных капилляров.
Для данной стадии хараткерны: холемия, появление и увеличение в моче неконъюгированного билирубина, снижение степени уробилиногенемии и уробилиногенурии, а также уменьшение содержания стеркобилиногена в крови, моче и кале.
Третья (нарастающая желтушная) стадия отличается прогрессирующим:
- снижением активности глюкуронилтрансферазы, а, значит, нарушением процесса глюкуронизации билирубина и угнетением трансмембранного переноса его конъюгированной формы. Это проявляется нарастанием содержания непрямого и снижением прямого билирубина в крови,




|
 | |||||
| |||||
|
 |  | ||||
 | |||||
|
2.
|




 | |||||||
|
| ||||||
 |

3.
|
 |  |


 |





 |  |


 2015-04-30
2015-04-30 1161
1161
