В газе, находящемся в состоянии равновесия, устанав- ливается некоторое стационарное распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону.
Пусть скорости dN молекул попадают в интервал от u до u+du. Относительное число молекул, скорости которых лежат в указанном интервале, отнесённое к ширине интервала du, называется функцией распределения молекул по скоростям
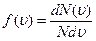 . (2.9)
. (2.9)
Функция распределения молекул газа по скоростям была получена Максвеллом и имеет следующий вид:
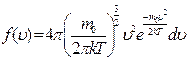 . (2.10)
. (2.10)
Здесь m0 - масса отдельной молекулы, k – постоянная Больцмана, T – температура. Тогда число молекул, скорости которых заключены в пределах от u до u+du, определяется выражением
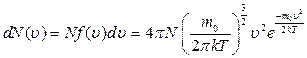 , (2.11)
, (2.11)
где N – общее число молекул.
График функции 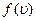 представлен на рис. 2.1.
представлен на рис. 2.1.
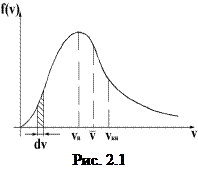
Площадь заштрихованного участка 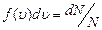 равна доле молекул, скорости которых лежат в интервале от u до u+du. Просуммировав доли молекул, во всем интервале скоростей, получим единицу. Это означает, что площадь, ограниченная функцией
равна доле молекул, скорости которых лежат в интервале от u до u+du. Просуммировав доли молекул, во всем интервале скоростей, получим единицу. Это означает, что площадь, ограниченная функцией 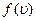 и осью абсцисс, равна единице
и осью абсцисс, равна единице
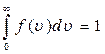 . (2.12)
. (2.12)
Выражение (2.12) представляет собой условие нормировки функции распределения молекул по скоростям.
Конкретный вид функции зависит от рода газа и от температуры. С повышением температуры максимум функции смещается вправо (рис.2.2). Площадь же, ограниченная кривой, остается неизменной, поэтому с повышением темпера- туры кривая растягивается и понижается.
|
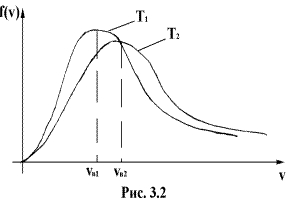
С ростом температуры увеличивается доля молекул, имеющих большую скорость. Скорость, при которой функция 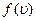 достигает максимума, называется наиболее вероятнойскоростью. Этой и близкой к ней скоростью обладает наибольшее число молекул. Значение наиболее вероятной скорости можно найти из условия
достигает максимума, называется наиболее вероятнойскоростью. Этой и близкой к ней скоростью обладает наибольшее число молекул. Значение наиболее вероятной скорости можно найти из условия 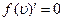 .
.
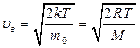 , (2.13)
, (2.13)
где m0 - масса молекулы, М - молярная масса.
Наряду с наиболее вероятной скоростью в молекуляр- но - кинетической теории пользуются понятием средней арифметической и средней квадратичной скорости:
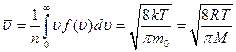 , (2.14)
, (2.14)
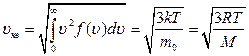 . (2.15)
. (2.15)
Значение средней квадратичной скорости, рассчитан- ной по закону Максвелла, совпадает с ранее полученным выражением (2.8).
 2015-05-14
2015-05-14 2048
2048
