Налейте в четыре пронумерованные пробирки (№ 1, 2, 3, 4) пипеткой по 2 мл 2,5%-ного раствора серной кислоты, а в другие четыре пробирки (№ 1а, 2а, За, 4а) - по 2 мл 5%-ного раствора тиосульфата натрия. Объемы отмеряйте возможно точнее, пользуясь мерными пипетками.
Все пробирки поставьте в стакан с холодной водой. Через 5 минут измерьте температуру воды в стакане. Выньте из воды пробирки 1 и 1а, быстро прилейте раствор серной кислоты в раствор тиосульфата натрия (не забудьте перемешать). Отметьте время по секундомеру от момента сливания до появления слабой мути. Концом реакции считайте едва заметное помутнение раствора. Запишите результаты в таблицу.
| № опыта | Объем раствора 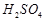 , мл , мл | Объем раствора 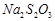 , мл , мл | Относительная концентрация 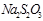 , М , М | Температура, 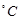 | Время,с |
Второй опыт (с пробирками 2 и 2а) проведите аналогично первому но при температуре на 10°С выше первоначальной, для чего следствие пару пробирок нагрейте в стакане с водой, температура которой контролируется термометром. Слейте вместе пробирки и отметьте, что наблюдается.
Третий опыт (с пробирками 3 и За) проведите при температуре на 20°С выше первоначальной, нагревая растворы таким же образом, как указано выше.
Наконец, нагрев воду в стакане еще на 10°С, проведите опыт растворами 4 и 4а.
Все результаты запишите в таблицу. Постройте графики зависимости скорости реакции от температуры, откладывая по оси абсцисс температуру, а по оси ординат - скорость реакции.
Опыт 3. Скорость гетерогенных реакции.
Возьмите два одинаковых по размеру кусочка мела (СаСОз). Один из них разотрите в ступке в порошок и ссыпьте его на лист бумаги.
Налейте в две пробирки по 5 мл раствора соляной кислоты и одновременно в одну бросьте кусочек мела, а в другую - ссыпьте порошок.
В какой из пробирок реакция пошла быстрее и почему? Составьте уравнение реакции взаимодействия мела с соляной кислотой. Напишите уравнение для скорости этой реакции.
Сделайте вывод о зависимости скорости реакции от поверхности соприкосновения веществ.
Не забудьте помыть за собой посуду и убрать рабочее место!
? Контрольные вопросы:
1. Как выражается зависимость скорости реакции от концентрации реагирующих веществ? Проходит ли график функции, описывающей эту зависимость, через начало координат?
2. Как влияет изменение температуры на скорость химической реакции?
3. Из полученных в опыте 2 результатов температурой найти коэффициент (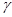 ) скорости реакции между
) скорости реакции между 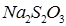 и
и 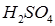 .
.
4. Что называется энергией активации?
5. Какой физический смысл имеет констант скорости химической реакции?
 2015-05-10
2015-05-10 709
709







