Электролитическое осаждение - процесс выделения металла на катоде при прохождении через раствор (электролит) постоянного тока. Обычно электролитами служат такие растворы, в которых металл присутствует в виде сульфата или хлорида, находящихся в диссоциированном состоянии: MeSO4 ↔ Ме2+ + SO42-. Часть молекул воды тоже диссоциирует Н2О ↔ Н+ + ОН-. Находящиеся в растворе ионы под действием электрического тока движутся к электродам: положительно заряженные ионы (катионы) направляются к электроду, соединенному с отрицательным полюсом источника тока - к катоду, а отрицательно заряженные ионы (анионы) - к положительному электроду, аноду. На электродах ионы теряют заряд, выделяясь в виде атомов (молекул), или образуют химические соединения.
Закон Фарадея. Закон Фарадея устанавливает, что при разложении различных соединений одним и тем же количеством электричества на электродах выделяются количества вещества, пропорциональные их электрохимическим эквивалентам: 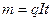 , где: т - количество выделенного на электроде вещества, мг; I - сила тока, а; t - время прохождения тока, сек; q — электрохимический эквивалент (количество вещества выделяемого одним кулоном электричества - током в 1 а в течение 1 сек).
, где: т - количество выделенного на электроде вещества, мг; I - сила тока, а; t - время прохождения тока, сек; q — электрохимический эквивалент (количество вещества выделяемого одним кулоном электричества - током в 1 а в течение 1 сек).
|
|
|
Для выделения грамм-эквивалента любого иона через электролит необходимо пропустить одно и то же количество электричества, равное 96520 к. Это число называют числом Фарадея и обозначают - F. Подставляя значение электрохимического эквивалента, получаем: 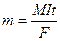 .
.
Выход по току и коэффициент использования энергии. При электролизе часть тока расходуется непроизводительно. На катоде может выделяться не только металл, но и водород. Образовавшийся катодный осадок может подвергаться окислению и растворяться. При электролизе неизбежна некоторая утечка тока. Указанные причины сниженают выход по току, который определяется отношением количества фактически отложившегося на катоде вещества к тому количеству вещества, которое соответствует прошедшему через электролит количеству электричества: 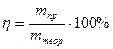 , где:
, где: 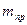 - количество вещества, практически отложившееся на электроде;
- количество вещества, практически отложившееся на электроде; 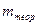 - теоретическое количество отложенного вещества.
- теоретическое количество отложенного вещества.
При электролизе около электродов собираются продукты электролиза и образуется гальванический элемент, дающий ток в обратном направлении. Электродвижущая сила такого тока называется электродвижущей силой поляризации. В результате возникновения электродвижущей силы поляризации электролиз может прекратиться, если не увеличить напряжения на электродах. Минимальное напряжение внешнего источника тока, которое необходимо приложить к электродам, чтобы началось разложение электролита, называется напряжением разложения.
|
|
|
Таким образом, не вся электрическая энергия расходуется на электролиз; часть ее идет на преодоление сопротивлений и прочие неизбежные потери. Поэтому важным показателем электролизной установки является коэффициент использования энергии.
Коэффициент использования энергии - отношение количества энергии, теоретически необходимого для электролиза 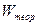 , к израсходованному количеству энергии
, к израсходованному количеству энергии 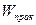 :
: 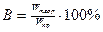 .
.
Энергия, теоретически необходимая для получения при электролизе единицы массы металла, определяется умножением количества электричества, необходимого для осаждения металла, на напряжение разложения: 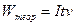 .
.
Катодный процесс. На катоде разряжаются катионы: Ме2+ + 2е = Me. Процесс присоединения электронов называется восстановитальным. В результате приведенной реакции образуется осадок, формирование которого идёт в 3 стадии: 1) адсорбции иона на поверхности катода; 2) разряда иона; 3) образования кристаллической решетки и роста кристалла.
В зависимости от режима электролиза металлы могут осаждаться или в виде плотного осадка равномерной толщины, или в виде порошка, или в виде рыхлого кристаллического слоя (губчатые осадки). Иногда образуются древовидные отростки, называемые дендритами.
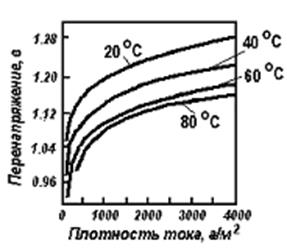
Рисунок 13.1 – Зависимость ή от Dk и Т
При электролитическом осаждении металла стараются получать плотный осадок, равномерного строения. В некоторых случаях получениют порошкообразные катодные осадки. На качество катодного осадка влияет введение в электролит коллоидов (желатины, столярного клея), которые адсорбируются поверхностью растущих на катоде кристаллов, обволакивают кристаллические центры и препятствуют их дальнейшему росту; поэтому катодный осадок получается мелкокристаллической структуры. Адсорбируемый слой коллоидов концентрируется на выпуклостях, имеющихся на катодной поверхности, и, препятствуя их дальнейшему росту, способствует выравниванию поверхности катодного осадка.
Присутствующие в растворах ионы водорода могут разряжаться на катоде вместе с ионами металла, если потенциал выделения водорода равен или меньше потенциала выделения металла. Потенциал выделения водорода зависит от материала катода, от состояния его поверхности. Наименьший потенциал выделения водорода наблюдается на губчатой платине. Зависимость перенапряжения водорода от плотности тока может быть выражена эмпирическим уравнением Тафеля: 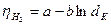 , где:
, где: 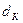 — плотность тока; а и b — постоянные (а зависит от материала электрода, состояния его поверхности, состава электролита и температуры, b расчитывается по формуле:
— плотность тока; а и b — постоянные (а зависит от материала электрода, состояния его поверхности, состава электролита и температуры, b расчитывается по формуле: 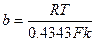 ).
).
Для выделения водорода со скоростью, соответствующей плотности тока, требуется дополнительная затрата энергии на восстановление иона водорода: Н+ + ē → Н, чтоприводит к перенапряжению 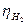 .
. 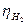 различен на различных металлах, некоторые металлы катализируют реакцию.
различен на различных металлах, некоторые металлы катализируют реакцию.
С увеличением 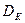
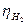 возрастает, с повышением Т - уменьшается (рисунок 1). Образование Н2 слагается из следующих стадий: 1) дегидратация ионов водорода, 2) разряд ионов водорода, 3) образования молекул водорода на поверхности катода; 4) отрыва пузырьков водорода с катода и выделения их в газовую фазу. Эта цепь процессов может быть изображена следующей схемой: Н3О+→ Н+ →
возрастает, с повышением Т - уменьшается (рисунок 1). Образование Н2 слагается из следующих стадий: 1) дегидратация ионов водорода, 2) разряд ионов водорода, 3) образования молекул водорода на поверхности катода; 4) отрыва пузырьков водорода с катода и выделения их в газовую фазу. Эта цепь процессов может быть изображена следующей схемой: Н3О+→ Н+ → 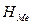 →
→ 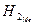 → Н2 ↑. Последняя стадия - выделение образовавшегося на катоде водорода - протекает тем успешнее, чем меньше поверхностное натяжение на границе жидкость - газ и чем оно больше на границе электрод - жидкость.
→ Н2 ↑. Последняя стадия - выделение образовавшегося на катоде водорода - протекает тем успешнее, чем меньше поверхностное натяжение на границе жидкость - газ и чем оно больше на границе электрод - жидкость.
Выделение электроположительных металов происходит без особых затруднений, осаждение же электроотрицательных металлов идет успешно только при малых концентрациях водородного иона в электролите или при высоком перенапряжении водорода. Катодное осаждение кадмия и цинка возможно потому, что водород на них выделяется со значительным перенапряжением.
|
|
|
Прибавление в электролит коллоидов увеличивает перенапряжение водорода.
Анодный процесс. На аноде происходит разряд аниионов. При электролизе сернокислых растворов к аноду идут ионы гидроксила и кислотного остатка. Из этих двух ионов разряжаться на аноде будет тот, у которого потенциал более электроотрицательный, т. е. ион гидроксила. Так как гидроксильная группа после потери заряда неустойчива, то разряд иона гидроксила сопровождается образованием воды и выделением кислорода у анода: 4ОН- - 4е = 2Н2О + О2.
В кислых электролитах происходит разряд молекул воды: Н2О - 2е = 2Н+ + 0.5О2.
При высокой плотности тока осадки получаются крупнокристаллическими, непрочно связанными с поверхностью катода, при низкой - мелкокристаллические, плотно пристающие к катоду.
На характер катодного осадка значительно влияет присутствие различных загрязнений в электролите. Одни примеси способствуют образованию древовидных наростов, другие приводят к получению дырчатых катодных отложений.
Из более концентрированных растворов получают катодные осадки плотные и мелкокристаллические; с понижением концентрации электролита осадок становится все менее плотным, наконец, рыхлым и даже порошковидным, легко осыпающимся с катода.
 2015-05-12
2015-05-12 5552
5552
