Установка лапаропортов у больных с портальной гипертензией является ответственной и небезопасной процедурой. При осуществлении оперативного доступа необходимо избегать введения троакаров в анатомических областях, характерных для формирования портокавальных шунтов. Наиболее опасной зоной является область проекции пупочной вены — средняя линия в эпигастрии и верхняя околопупочная точка.
Приведем следующее наблюдение:
|
В одну из клиник Санкт-Петербурга поступила больная В., 21 года, (и/б № 4713), с массивным асцитом, для проведения дифференциального диагноза между диффузным заболеванием печени, злокачественным новообразованием и сосудистой патологией портальной системы. Для верификации диагноза решено было произвести диагностическую лапароскопию. При установке видеопорта в верхней околопупочной точке произошло повреждение реканализированной пупочной вены, которое не было распознано во время операции, так как гильза троакара, видимо, тампонировала место повреждения. В связи с гемодинамическими признаками геморрагии больная повторно взята в операционную через 3 часа после первой операции. При ревизии установлен источник кровотечения, лигираван прошиванием. Несмотря на то, что проводилась гемотрансфузия и интенсивная терапия, массивная кровопотеря привела к развитию печеночной недостаточности и гибели больной к исходу суток. При патологоанатомическом исследовании у больной выявлен синдром Budd-Chiari, смерть наступила от полиорганной недостаточности, развившейся нафоне постгеморрагической анемии и исходно сниженной функции печени.
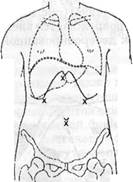
Рис. 56.Точки размещения лапаропортое для еыполнения оментогепато-, оментогепатофренопексии и операции типа Kalb.
Таким образом, первый троакар (видеопорт) у больных циррозом печени необходимо вводить в нижней околопупочной точке (рис.56). При установке дополнительных лапаропортов необходимо все манипуляции осуществлять под обязательным визуальным контролем и использовать прием, называемый трансилюминацией, который всегда позволяет выявить крупные сосуды передней брюшной стенки. Точку введения троакара в эпигастральной области следует смещать влево от средней линии, чтобы исключить повреждение круглой связки и проходящей в ней пупочной вены.
После введения лапароскопа обязательно производится ревизия брюшной полости, визуальная оценка состояния печени и других органов.
При оценке состояния печени и портальной системы учитывают:
· размеры печени, равномерность изменений в левой и правой долях;
· цвет поверхности печени;
· характер поверхности печени;
· плотность печени (по данным инструментальной «пальпации»);
· наличие и характер свободной жидкости в брюшной полости;
· размеры селезенки, наличие периспленита;
· расширение вен портальной системы, наличие естественных порто-
· кавальных анастомозов.
Важным моментом является возможность сопряжения эндовидеохирургического оборудования с системой видеозаписи. Это позволяет проводить консультации, консилиумы отсрочено, вне реального режима времени; оценить динамику процесса при релапароскопии; создавать учебные пособия и базы данных с редко встречаемой патологией.
Техника эндовидеохирургической оментогепато- и оментогепатофренопексии
Для создания оментогепатопексии дополнительные лапаропорты устанавливают: 10-мм — в эпигастральной области, 5-мм — в точке на 1,5 - 2,0 см ниже края реберной дуги по среднеключичным линиям с обеих сторон (рис.566).
Исследуют подвижность большого сальника для определения анатомически обоснованного типа органоанастомоза. Диафрагмальную поверхность печени коагулируют электрокоагулятором с шаровидным наконечником по Д.В. Усову (1994) (рис. 57, приводится в авторском варианте). Этим же инструментом повреждается висцеральная брюшина большого сальника. После этого сальник десерозированной поверхностью перемещают на диафрагмальную поверхность печени с помощью эндозажима. Производится фиксация края сальника к печени 2 - 4-мя одиночными швами (викрил с атравматической иглой). Следующим этапом производят рассечение париетальной брюшины боковых отделов брюшной полости до 20 см, используя электрокоагулятор с крючковидным наконечником. Затем брюшина тупо отслаивается эндодиссектором для обнажения забрюшинного пространства (операция типа Kalb). С левой стороны к месту деперитонизации укладывают нисходящий отдел ободочной кишки. На этом вмешательство заканчивают.
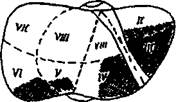
Рис. 57. Схема диатермогепатокоагуляции (приводится по Д.В. Усову, 1994).
Для формирования оментогепатофренопексии, создание пневмоперитонеума и введение троакаров осуществляют как и при вышеописанной методике. Производят гепатокоагуляцию по Д.В. Усову (1994). Затем изучают подвижность большого сальника и, убедившись в выполнимости оменто- френогепатопексии, производят деперитонизацию правого купола диафраг- мы. Суть этого приема заключается в выкраивании П-образного лоскута брюшины - 15,0 х 7,0 см на поверхности диафрагмы, обращенной к правой доле печени. Лоскут формируют так, чтобы основание его находилось снизу с точки зрения оперирующего. Для облегчения задачи производится гидропрепаровка диафрагмальной брюшины раствором 0,25% новокаина с помощью длинной пункционной иглы, вводимой через брюшную стенку, крючковидным электрокоагулятором производится точечное поверхностное повреждение брюшины в месте намеченной линии разреза в образованное отверстие вводят рабочую часть крючковидного электрокоагулятора и под обязательным визуальным контролем, небольшими порциями по 2 — 3 мм осуществляют намеченную линию разреза.
Во время осуществления оперативного приема необходимо помнить о возможности перфорации диафрагмы и развития пневмоторакса [36], поэтому все движения коагулятора должны быть строго контролируемы, в момент электрокоагуляции тракция коагулятора должна быть в сторону рабочего троакара. Необходимо помнить о расположении крупных диафрагмальных сосудов, повреждения которых необходимо избежать.
Следующим этапом, используя эндодиссектор и электрокоагулятор с шаровидным наконечником, отсепаровывают лоскут брюшины. Затем лоскут низводится за дорсальную поверхность печени.
Висцеральную брюшину большого сальника десерозируют поверхностной электрокоагуляцией. Последний перемещают на диафрагмальную поверх- ность печени и свободным краем фиксируют в 2 — 4-х местах к основанию мобилизованного лоскута диафрагмальной брюшины. Фиксацию осуществляли тремя способами: 1) эндошвами с интракорпоральным формированием узлов; 2) танталовыми скрепками с помощью эндостеплера; 3) танталовыми клипсами с помощью эндоклипатора.
В ряде случаев некоторые варианты оментопексий технически неосуществимы. Это бывает связано либо с атрофией большого сальника, либо с наличием спаечного процесса и сращений сальника с органами брюшной полости, разрушать которые нецелесообразно, так как они являются естественными органоанастомозами.
Техника энловилеохиочогической экстоапеоитонизапии правой доли печени. Создается пневмоперитонеум и вводятся троакары также как и при описанных ранее типах операций. После создания карбоксиперитонеума традиционным способом и установки дополнительных лапаропортов в рассчитанных точках, производится гидропрепаровка диафрагмальной брюшины над правой долей печени. Затем производится П-образное рассечение отсепарованной брюшины, причем основание создаваемого лоскута должно быть сверху, с точки зрения оперирующего. Обработка с целью десерозирования диафрагмальной поверхности печени производится приемами, описанными выше в методике оментогепатофренопексии. Диафрагмальная поверхность печени при этом плотно прижимается к десерозированной диафрагме, обеспечивая условия для развития сращений, а выкроенный диафрагмальный лоскут отграничивает печень от брюшной полости. Операция завершается также как и при описанных ранее методиках.
Результаты применения эндовидеохирургического формирования органоанастомозов в клинике
В нашей клинике 65 пациентов подверглись эндовидеохирургическому формированию органоанастомозов. 20 пациентам органоанастомозы выполнены традиционным способом, они составили группу сравнения.
Длительность заболевания составляла у мужчин от нескольких месяцев до 6-ти лет (в среднем 2,3 года), у женщин — от нескольких недель до 7 лет (в среднем 2 года). На догоспитальном этапе эпизоды геморрагии выявлены у 12 (14,12%) больных. У 6 из них были пищеводные кровотечения, у остальных 6 — другой локализации (десневые, носовые, геморроидальные). В подавляющем большинстве случаев (5) пищеводные кровотечения наблюдались у мужчин. Асцит ранее возникал у 36 (42,35%). Систематическое консервативное лечение по поводу цирроза печени ранее проводилось 47 обследованным.
После обследования у пациентов выявлены следующие синдромы:
· гиперспленизм, в виде лейкопении, тромбоцитопении, эритроцитопении: у 31 — 36,5%;
· анемия, проявляющаяся эритроцитопенией и снижением уровня гемоглобина в крови ниже 132 г/л у мужчин и 115 г/л у женщин: у 46 — 54,1%;
· цитолитический синдром, характеризующийся повышением активности АЛТ, АСТ, увеличением уровня билирубина, снижением содержания в крови факторов свертывания, альбуминов: у 39 — 45,9%;
· холестатический синдром, характеризующийся увеличением в сыворотке крови билирубина, активности щелочной фосфатазы, содержания жирных кислот, холестерина: у 51 — 60%;
· мезенхимально-воспалительный синдром, характеризующийся увеличением селезенки, СОЭ, эозинофилией, повышением содержания а, и сqглобулинов в сыворотке крови: у 19 — 22,35%.
Диагностическая лапароскопия была произведена 81 пациенту. Из них 65 выполнена прицельная щипковая биопсия печени. Одновременно решался вопрос о возможности эндовидеохирургической операции.
65 пациентам с верифицированным диагнозом цирроза печени произведено эндохирургическое формирование органоанастомозов. Оментогепато-,
ТАБЛИЦА 23. Распределение больных по типам произведенных хирургических вмешательств
| Название операции | Количество б-х |
| Лапароскопическая оментогепато-, оментогепатофренопексия Лапароскопическая экстраперитонизация печени Лапароскопическая операция типа Kalb Трансторакальная гепатопневмопексия «Традиционные» оргаиоанастомозы» Всего |
либо оментогепатофренопексия с диатермогепатокоагуляцией выполнена 20 больным портальной гипертензией, обусловленной циррозом печени. У 12 из них вмешательство дополнено операцией типа Kalb. Операция экстраперитонизации печени (гепатофренопексия) произведена 26 больным. В том числе 14 из них вмешательство выполнено с диатермо-, а 12 — с лазерогепатокоагуляцией. Восемнадцать пациентов подверглись лапароскопическому варианту операции Kalb, среди них было 12 мужчин и 6 женщин. Двадцати пациентам органоанастомозы созданы традиционным способом, посредством лапаротомии.
32 больным вмешательство произвели на фоне асцитического синдрома, у остальных 26 выраженного асцита не было, либо он купирован консервативными мероприятиями или наружной аутореинфузией асцитической жидкости, а затем, вмешательство проведено при отсутствии асцита. Распределение пациентов по типу операции отражено в таблице 23.
Длительность вмешательств без сочетания с операцией типа Kalb составила от 65 до 105 минут (в среднем — 76,5~5,07 минут). В сочетании с операцией Kalb — от 70 до 135 минут (в среднем — 91,54~4,58 минут).
Основной причиной невозможности выполнения оментопексий в 8 (12,3%) случаях была атрофия большого сальника, либо участие его в спаечном процессе.
Интраоперационные осложнения возникли у 7 больных: инсуффляция газа в предбрюшинную клетчатку — 1; кровотечение при биопсии печени, потребовавшее прошивания эндошвом — 2; кровотечение во время проведе- ния через край печени нити при экстраперитонизации — 1 (остановлено электрокоагуляцией); кровотечение при рассечении брюшины в области правого бокового канала — 2 (остановлено прошиванием и электрокоагуляцией); массивное кровотечение, связанное с ранением пупочной вены при введении эпигастрального троакара близко к средней линии — 1 (потребовало ревизии троакарного канала и прошивания источника). Одна больная (стадия С по Child) погибла от печеночной недостаточности на фоне постгеморрагической анемии (данное клиническое наблюдение было приведено ранее).
Профилактика осложнений, связанных с гемодинамическим эффектом лапароскопических вмешательств, особенно у пациентов с портальной гипертензией, заключается в создании так называемого «щадящего карбоксиперитонеума». Под этим термином подразумевается использование современных инсуффляторов, не допускающих неконтролируемых колебаний внутрибрюшного давления, режим медленной инсуффляции и десуффляции (не более 4 и 8 л/мин соответственно), минимальное, для выполнения данной операции, «рабочее» внутрибрюшное давление (рекомендуемое — 8 — 10 мм.рт.ст.).
Для нивелирования изменений гемодинамики, у пациентов с асцитическим синдромом, рекомендуется проводить эвакуацию асцитической жидкости одновременно с инсуффляцией газа, что обеспечивает плавное достижение необходимого внутрибрюшного давления в начале лапароскопии. У больных с напряженным асцитом целесообразно завершить операцию герметизацией брюшной полости при интраабдоминальном давлении 6 — 8 мм рт.ст. Медленная резорбция СО2 обеспечит плавное снижение давления в брюшной полости.
Течение послеоперационного периода у пациентов с портальной гипертензией, перенесших эндохирургическое формирование органоанастомозов
Независимо от типа производимого эндовидеохирургического вмешательства, в первые сутки после операции у 32 (49,2%) пациентов наблюдаются тошнота, рвота, тахикардия, быстро проходящие, на фоне проводимой стандартной терапии, ко вторым суткам.
Болевой синдром, требующий назначения наркотических анальгетиков, отмечается у 7 — 8% пациентов. Обычно он сохраняется не более 2-х суток. Чаще достаточным является введение ненаркотических анальгетиков в течение 2 — 3-х суток.
У всех пациентов в первые сутки послеоперационного периода отмечается кратковременный субфебрилитет, который исчезает к исходу вторых суток после операции.
У 4 (6,2%) больных в послеоперационном периоде развилась застойная пневмония, которая благополучно разрешилась к 10-му дню после операции на фоне приема антибиотиков.
Из осложнений, возникающих в послеоперационном периоде наиболее опасно развитие ДВС-синдрома. В наших наблюдениях — 1 случай: у больного с циррозом печени в стадии С no Child в первые сутки после операции развилась клиника внутрибрюшного кровотечения. Релапароскопия и произведенная лапаротомия не позволили выявить источник кровотечения. Отмечалась массивная диффузная кровоточивость в местах деперитонизации и с краев лапаротомной раны. При анализе коагулограмм состояние было расценено как коагулопатия потребления вследствие развития ДВС-синдрома. Применение всего арсенала местных и системных гемостатических средств не ликвидировало кровотечения и завершилось летальным исходом.
У остальных пациентов послеоперационный период протекал благоприятно и все они благополучно выписаны из клиники в удовлетворительном или хорошем состоянии на 4 — 14 сутки после операции (в среднем на 8 день).
Дренаж из правого бокового канала удалялся на 2 — 4 сутки после операции. Истечение асцитической жидкости свыше 150 мл в сутки наблюдалось у 7 (10,8%) больных, с выраженным исходным асцитом.
Заживление троакарных ран первичным натяжением констатировано в 54 случаях (83,1%). Этим пациентам кожные швы снимались на 5 — 6-е сутки. Нагноение послеоперационных ран возникло в 1 (1,5%) случае. Возникновение сером и гематом в области троакарного канала отмечено у 4 (6,15%) пациентов. Этим пациентам кожные швы снимались в день выявления осложнения и заживление ран происходило вторичным натяжением.
У 6 (9,2%) пациентов, в послеоперационном периоде происходило длительное истечение асцитической жидкости через троакарные раны, чаще в околопупочной области. Это потребовало повторной ревизии раны, с послойным герметичным ушиванием апоневроза и кожи.
Анализ осложнений раннего послеоперационного периода (кровотечения и истечение асцитической жидкости из мест троакарных пункций) показал исключительную важность завершения операции у этой категории больных герметичным ушиванием троакарных ран. С этой целью, наряду с обычным, наружным швом, мы стали использовать эндоиглы типа Maciol, принцип действия которой описан в главе, посвященной лапароскопической холецистэктомии.
С помощью этой иглы, по окончании операции, перед извлечением троакаров, в брюшную полость под видеоконтролем проводится конец нити. Выдвигая крючок, удерживающий нить, освобождают последнюю и, фиксируя конец нити эндозажимом, производят извлечение иглы. Через другой прокол той же иглой извлекают проведенный конец нити наружу, захватывая последний выдвижным крючком иглы. Накладывая таким образом необходимое количество швов, извлекают троакары, после чего производят затягивание нитей.
Данная техника позволяет быстро и эффективно остановить внутреннее кровотечение из раневых каналов и избежать асцитореи через раневые каналы в послеоперационном периоде. Применение этой техники ушивания троакарных ран у 10 пациентов показало: асцитореи, кровотечения, формирования гематомы или серомы в области троакарных каналов не возникло ни у одного пациента.
Отдаленные результаты эндовидеохирургического формирования органоанастомозов в купировании асцитического синдрома у пациентов с портальной гипертензией
Отдаленные результаты эндовидеохирургического формирования органоанастомозов изучены в сроки от 6-ти месяцев до 2-х лет у 56 больных. За этот период умерло 5 (7,7%) пациентов (4 в течение года после вмешательства, 1 — через 17 месяцев). Из живых пациентов субъективное улучшение после операции отметили 24 (47%) больных, состояние не изменилось у 17 (33,3%), ухудшение — 10 (19,6%).
Из 28 обследованных с исходным асцитическим синдромом, асцит полностью исчез у 13 (46,4%), уменьшился у 5 (17,8%), не претерпел изменений
ТАБЛИЦА 24. Результаты эндохирургического лечения в сроки от 6 мес. до 2 лет.
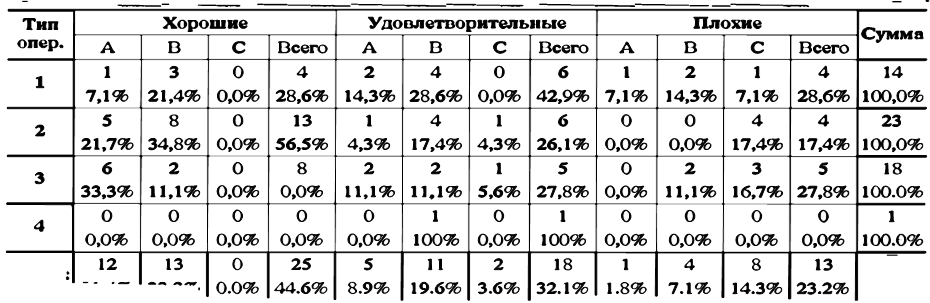
Примечание:
1. Оментогепато-, оментогепатофреиопексия, 2. Экстраперитоиизация печени, 3. Операция типа Kalb;
у 4 (14,39o), увеличился у 6 (21,4%). При этом достоверное увеличение суточного диуреза до 1407,49~178,33 мл в сутки, уменьшение окружности живота и веса тела установлено у 10 (62,59o) лиц с исходно сниженным суточным диурезом. Асцит у этих больных регрессировал. У 6 пациентов асцит сохранялся и требовал назначения мочегонных средств. Из них 5 больных имели исходно диуретикорезистентный асцит, который у 3 стал поддаваться диуретикотерапии.
Среди 17 пациентов, имевших эпизоды появления асцита в анамнезе, но оперировавшихся вне асцитического синдрома, результаты были следующими: эпизоды асцита более не возникали у 11 (64,7%) пациентов; возникали эпизоды асцита, но легко поддавались терапии у 4 (23,5%); в дальнейшем развился диуретикорезистентный асцитический синдром у 2 (11,8%).
Эти данные позволили произвести оценку эффективности эндовидеохирургических органоанастомозов в период от 6 месяцев до двух лет. Оценку осуществляли по трехбалльной системе (табл. 24, рис.58). Хорошими результатами считали случаи, когда асцит полностью исчезал и рецидивов его возникновения не наблюдалось. К удовлетворительным результатам относили случаи, когда асцит рецидивировал, Однако, объем и напряженность его была ниже, чем до операции, либо вмешательство позволило добиться снижения дозы диуретиков. Неудовлетворительными результатами считали летальные исходы и случаи, когда напряженность асцита не уменьшалась или происходило прогрессирование процесса.
 2015-05-12
2015-05-12 688
688








