Комплексные соединения с заряженной внутренней сферой ведут себя как сильные электролиты, т. е. практически полностью диссоциируют на ионы внешней сферы и комплексный ион:
[Cu(NH3)4]Cl2⇆[Cu(NH3)4]2+ + 2СI−
Na2[Zn(OH)]4⇆2Na+ + [Zn(OH)4]2−
Внутренняя сфера комплексного соединения ведет себя подобно очень слабому электролиту, так как связь комплексообразователя с лигандом ковалентная. Поэтому в растворах комплексных соединений устойчивая внутренняя сфера диссоциирует в очень незначительной степени (т. е. в этом случае процесс обратим):
[Ag(NH3)2]CI⇆[Ag(NH3)2]+ + CI−
[Ag(NH3)2]+®Ag+ + 2NH3
Применяя закон действующих масс к этим обратимым процессам, получим выражения констант нестойкости соответствующих комплексов:
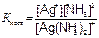 .
.
Константа нестойкости комплексного иона К нестхарактеризует прочность (или устойчивость) внутренней сферы комплексного соединения: чем меньше К нест, тем более устойчив комплексный ион.
Двойные соли также относятся к числу комплексных соединений, ибо принципиального различия между двойными солями и комплексными соединениями нет. Отличаются они лишь диссоциацией комплексного иона: у первых она практически полная, у вторых − незначительная.
Например, двойной хлорид калия и меди 2КСI ∙ СuСI2 ∙ 2Н2О можно рассматривать как комплексное соединение K2[CuCI4] ∙ 2Н2О, диссоциация которого происходит следующим образом:
K2[CuCI4] ∙ 2Н2О⇆2K+ + [CuCI4]2− + 2Н2О
[CuCI4]2−⇆Cu2+ + 4CI−.
Усилить диссоциацию и даже полностью разрушить комплексный ион можно тремя способами:
1) разбавлением и нагреванием раствора, содержащего этот ион;
2) добавлением реагентов, образующих с одним из компонентов комплексного иона малорастворимые или еще менее диссоциирующие молекулы или ионы;
3) применением окислителей или восстановителей.
Так, если к раствору, содержащему комплексный ион [Ni(NH3)6]2+, добавить раствор сульфида натрия, комплексный ион разрушится за счет образования осадка сульфида никеля NiS:
[Ni(NH3)6]2+ + S2− = NiS¯ + 6NH3
Объясняется это тем, что ионы Ni2+ прочнее связаны в труднорастворимом сульфиде NiS, растворимость которого чрезвычайно мала
(ПPNiS = 1,4 ∙ 10−24).
Если же раствор Na2S заменить раствором NaOH, то разрушить комплекс [Ni(NH3)6]2+ не удается, так как ионы Ni2+ в комплексе связаны более прочно, чем в гидроксиде Ni(OH)2, растворимость которого значительно больше, чем растворимость NiS (ПРNi(0Н)2 = 8,7 ∙ 10−19). Иными словами, концентрация ионов Ni2+ в растворе оказывается недостаточной, чтобы превысить величину ПР, следовательно, осадок Ni(OH)2 не образуется.
Разрушение комплекса за счет образования менее диссоциирующего комплексного иона происходит, например, при добавлении сильной кислоты к раствору, содержащему комплексный ион [Cu(NH3)4]2+, при этом образуется более прочный ион аммония NH4+:
[Cu(NH3)4]2+ + 4H+ = Cu2+ + 4NH4+.
Примером разрушения комплексных ионов при окислительно-восстановительных реакциях может служить процесс получения золота из его цианидного комплекса:
2K[Au(CN)2] + Zn = 2Au + K2[Zn(CN)4].
Вопросы для самоподготовки
- Какие соединения называются комплексными соединениями?
2. Что является характерной особенностью комплексных соединений?
3. Что называется комплексообразователем, лигандом, внутренней сферой, внешней сферой?
4. Что такое координационное число?
5. Что является характеристикой комплексообразователя?
6. Определите степень окисления атома кобальта в комплексном соединении [Co(NH3)4(NO2)2]CI.
7. Запишите формулу комплекса, в котором комплексообразователем является Fe+2 с координационным числом 6, а лигандоми – ионы CN-.
ТЕСТЫ
1. Заряд комплексообразователя в [Ni(H2O)2(NH3)3Cl]Cl2 равен
а) +3;
б) +2;
в) +4;
г) +1
2. Формулой гексацианохромита калия является:
а) K4[Cr3(CN)6];
б) K3[Cr2(CN)5];
в) K3[Cr(CN)5];
г) K3[Cr(CN)6].
3. Формуле [Co(H2O)2(NH3)2(NO2)2]CI соответствует название
а) хлорид динитродиамминдиаквакобальта (III);
б) хлорид динитродиамминдиаквакобальта (II);
в) хлорит нитритодиамминдиаквакобальта (III);
г) хлорид динитритодиамминдиаква кобальта (II).
4. Координационное число комлексообразователя в [Fe(NH3)3(H2O)(OH)2]NO3 равно
а) 5;
б) 6;
в) 4;
г) 3.
5. Лигандом в комплексном соединении K2[SiF6] является
а) калий;
б) кремний;
в) фтор.
 2015-05-13
2015-05-13 10315
10315
