Изучение кинетики действия ферментов позволяет получить информацию о механизмах ферментативных реакций. Впервые кинетика действия ферментов была удовлетворительно объяснена, когда был выдвинут постулат о том, что фермент обратимо соединяется со своим субстратом, образуя промежуточный комплекс фермент– субстрат. Пионерами в этой области были Генри (1903) и Михаэлис и Ментен (1913), и их концепции подтвердились, когда с помощью спектроскопических методов было доказано образование постулированных комплексов при изучении каталазы и пероксидазы (1936–1937гг.) Позднее в ряде случаев оказалось возможным выделить ковалентные фермент–субстратные соединения в количестве, достаточном для их дальнейшего исследования. Образовавшийся комплекс фермент–субстрат может претерпевать далее различные превращения.
В любой ферментативной реакции можно выделить три стадии. На первой стадии фермент Е взаимодействует с субстратом S, в результате чего образуется комплекс фермент–субстрат ES. Это взаимодействие происходит настолько быстро, что его крайне трудно исследовать без специальных приборов. В общем случае, когда количество субстрата значительно больше количества фермента, убыль свободного субстрата на этой стадии обнаружить весьма нелегко. Концентрация комплекса ES увеличивается, достигая уровня, когда скорость его образования точно равна скорости его превращения в продукты реакции, т.е. достигается стационарное состояние, при котором 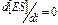 ; оно соответствует второй стадии реакции.
; оно соответствует второй стадии реакции.
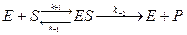 (1.1)
(1.1)
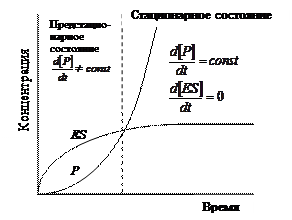 Предстационарное состояние длятся очень недолго, всего несколько миллисекунд.
Предстационарное состояние длятся очень недолго, всего несколько миллисекунд.
Скорость образования продукта P, которая на предстационарной стадии увеличивалась параллельно с повышением концентрации ES, оказывается постоянной на второй стадии (она равна 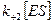 ). Если концентрация субстрата достаточно велика, то скорость образования продукта может оставаться постоянной в течение периода времени, достаточного для ее надежного определения. В большинстве работ по изучению кинетики действия ферментов эта постоянная скорость образования продукта, начальная скорость реакции, является экспериментально определяемым параметром.
). Если концентрация субстрата достаточно велика, то скорость образования продукта может оставаться постоянной в течение периода времени, достаточного для ее надежного определения. В большинстве работ по изучению кинетики действия ферментов эта постоянная скорость образования продукта, начальная скорость реакции, является экспериментально определяемым параметром.
Таким образом, в пределах отдельной цепи взаимосвязанных реакций всегда существуют стадии, различающиеся по скоростям.
В ряде случаев в биологических системах осуществляется известный принцип узкого места, согласно которому общая скорость превращения вещества по всей цепи реакций определяется наиболее медленной стадией.
Если отдельные стадии общего процесса обладают характерными временами t1, t2, …, tk, …, tn, и наиболее медленная стадия имеет время tk, такое, что tk>>t1, t2, …, tn, то определяющим звеном будет k –е звено, а общее время процесса практически совпадает со значением tk уз кого места.
В этом смысле медленное звено управляющее, поскольку воздействие именно на него влияет на скорость всего процесса.
Соответственно сказанному:
1) скорость реакции 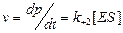 (1)
(1)
2) Материальный баланс по ферменту: 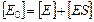 (2)
(2)
по субстрату 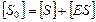 ,
,
т..к. 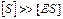 , то
, то 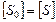 (3)
(3)
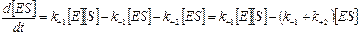
В стационарном состоянии 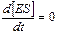
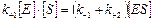 ;
; 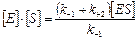 ;
; 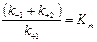 ;
;
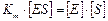 (3)
(3)
Выражаем [E] из уравнения материального баланса (2) и подставляем в уравнение (3).
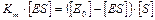
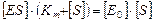
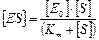 (4)
(4)
Выражение (4) подставляем в уравнение (1) 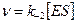
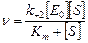 Уравнение Михаэлиса–Ментен (5)
Уравнение Михаэлиса–Ментен (5)
Максимальная скорость реакции 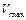 наблюдается в условиях, когда фермент насыщен субстратом, т.е. когда весь фермент находится в форме ES. Следовательно, можно написать:
наблюдается в условиях, когда фермент насыщен субстратом, т.е. когда весь фермент находится в форме ES. Следовательно, можно написать:
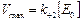
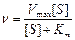 Уравнение Михаэлиса–Ментен (6)
Уравнение Михаэлиса–Ментен (6)
Константа Михаэлиса может быть определена как концентрация субстрата, при которой скорость реакции равна половине максимальной. 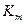 является характерной константой для данного фермента и имеет размерность концентрации.
является характерной константой для данного фермента и имеет размерность концентрации.
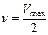
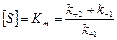
По решению Комиссии по ферментам Международного биохимического общества в ферментативной кинетике для характеристики процесса образования фермент–субстратного комплекса используют субстратную константу, или константу диссоциации комплекса Михаэлиса.
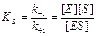 (7)
(7)
Из уравнения (7) следует, что в случае одинаковых концентраций фермента и субстрата, концентрация комплекса ES тем больше, чем меньше Ks, т.к.
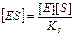
Субстратная константа определяется не абсолютными значениями k-1 и k+1, а их соотношением. Таким образом, мерой количественной оценки сродства субстрата к ферменту является субстратная константа. По экспериментальным данным изучения скорости реакции при различных концентрациях субстрата, можно непосредственно определить константу Михаэлиса Km, но не субстратную константу.
В большинстве случаев Km незначительно отличается от KS (она всегда больше KS) и может быть критерием меры сродства фермента к субстрату при условии: 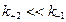 ,
, 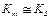 Для большинства ферментативных реакций константа скорости процесса диссоциации фермент–субстратного комплекса значительно больше, чем константа скорости его перехода в продукты реакции.
Для большинства ферментативных реакций константа скорости процесса диссоциации фермент–субстратного комплекса значительно больше, чем константа скорости его перехода в продукты реакции.
 2015-05-13
2015-05-13 1011
1011








