При нахождении кинетических параметров методом Диксона выполнить следующую последовательность действий:
- ввести вектор значений концентраций ингибитора;
- массивы для скоростей реакции сформировать следующим образом: каждому массиву задается новое имя (например, Vd1, Vd2 …); количество массивов равно числу концентраций субстрата; количество элементов в массиве соответствует количеству концентраций ингибитора. Элементами каждого массива являются значения скоростей реакции для выбранной концентрации субстрата при всех концентрациях ингибитора.
При нахождении константы ингибирования по методу Диксона для решения системы уравнений используется специальный вычислительный блок, состоящий из трех частей, идущих последовательно друг за другом:
- Given — ключевое слово;
- система уравнений, записанная в виде равенств.
- Find(x1...,хn) — встроенная функция для решения системы относительно переменных х1,...xn.
Блок Given/Find использует для поиска решения итерационные методы, поэтому перед ключевым словом Given требуется задать начальные значения для всех х. Значение функции Find есть вектор, составленный из решения каждой переменной. Таким образом, число элементов вектора равно числу аргументов Find.
|
|
|
Например, необходимо найти решение системы уравнений:
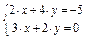
В программе MathCad запись решения системы будет выглядеть следующим образом:
Присваиваем начальные значения переменным х и y:

Вводим операторы блока Given/Find и систему уравнений:
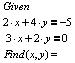
Знак равенства [  ] в системе уравнений вводится с помощью комбинации клавиш [Ctrl]+[=]; знак равенства после оператора Find служит для вывода результата на экран и вводится с клавиатуры нажатием обычного символа [=].
] в системе уравнений вводится с помощью комбинации клавиш [Ctrl]+[=]; знак равенства после оператора Find служит для вывода результата на экран и вводится с клавиатуры нажатием обычного символа [=].
Вариант 1
a-кетоглутарат является конкурентным ингибитором реакции окисления N-метил-L-глутамата, катализируемого N-метилглутамат-дегидрогеназой. Определить константу диссоциации комплекса фермент-ингибитор, исходя из данных таблицы.
Влияние a-кетоглутарата на кинетику окисления N-метил-L-глутамата, катализируемого N-метил-глутамат-дегидрогеназой. Условия опыта: рН 7,4, 30°С, фосфатный буфер; 3×10-5М 2,6-дихлориндофенола, [Е]0=6×10-2 мг/мл
| [a-кетоглутарат]×103, М | [S]0×104, М | V0×106, М×мин-1 |
| 1,00 0,625 0,500 0,417 0,264 | 1,669 1,43 1,33 1,205 1,053 | |
| 0,6 | 1,00 0,625 0,500 0,417 0,264 | 1,505 1,262 1,111 1,08 0,85 |
| 3,0 | 1,00 0,625 0,500 0,417 0,264 | 1,053 0,82 0,678 0,59 0,45 |
Вариант 2
Бензоат 1,2,5-триметилпиперидол-4(b-изомер) является ингибитором гидролиза бутирилхолина, катализируемого холинэстеразой. Определить тип ингибирования и найти константудиссоциации комплекса фермент-ингибитор, исходя из данных таблицы.
Влияние b-изомера бензоата 1,2,5-триметилперидола-4 на кинетику гидролиза бутирилхолина, катализируемого холинэстеразой. Условия опыта: рН 7,4; 25°С; фосфатный буфер (0,001М)
|
|
|
| [I]×105, M | [S]0×104, M | V, усл. ед. |
| 10,00 2,50 0,91 0,50 | 5,55 4,45 2,94 2,09 | |
| 1,0 | 10,00 2,50 0,91 0,50 | 4,00 3,18 2,16 1,49 |
| 2,0 | 10,00 2,50 0,91 0,50 | 2,86 2,28 1,52 1,06 |
| 3,0 | 10,00 2,50 0,91 0,50 | 2,38 1,85 1,24 0,87 |
Вариант 3
Исследовали влияние н-бутанола на кинетику гидролиза гиппурового эфира L-аргинина, катализируемого карбоксипептидазой В. Условия опыта: рН 8,0; 23°С; трис-ацетатный буфер (0,025 М); [Е]0=6,25×10-5 мг/мл. На основании зависимости скорости ферментативной реакции от начальной концентрации субстрата предложить кинетическую схему реакции (приняв двухстадийный механизм действия фермента) и определить константу ингибирования н-бутанолом.
| [н-бутанол], М | [S]0×104, М | V×106, M×мин-1 |
| 10,0 5,00 3,33 2,50 2,00 1,67 | 13,33 11,76 10,1 9,09 8,13 7,41 | |
| 0,05 | 10,0 5,00 3,33 2,50 2,00 1,67 | 8,7 7,35 6,45 5,71 5,21 4,72 |
| 0,15 | 10,0 5,00 3,33 2,50 2,00 1,67 | 5,35 4,60 4,08 3,60 3,21 2,98 |
Вариант 4
Кофермент А (СоА) является ингибитором реакции, катализируемой фосфат-ацетилтрансферазой:
Ацетил-СоА + фосфат ® Ацетилфосфат + СоА
В таблице приведены данные по влиянию СоА на начальную скорость реакции при вариации концентрации субстрата. Определить тип ингибирования коферментом по отношению к нуклеотидному (ацетил-СоА) субстрату и вычислить кинетические параметры исследуемого процесса.
Условия опыта: рН 8,32; 25°С; ионная сила 0,3 М; [Е]0=5×10-8 М
| [СоА]×105, М | [Ас-СоА]×105, М | V×105, М×мин-1 |
| 10,00 2,50 0,91 0,50 | 5,55 4,45 2,94 2,09 | |
| 0,5 | 10,00 2,50 0,91 0,50 | 4,77 3,78 2,56 1,79 |
| 1,0 | 10,00 2,50 0,91 0,50 | 4,00 3,18 2,16 1,49 |
Вариант 5
| В работе изучалось дезактивирующее влияние ингибитора на гидролиз этилового эфира N-бензоил-L-аргинина, катализируемый папаином (таблица). Исходя из двухстадийного механизма ферментативной реакции, вычислить возможные кинетические и равновесные параметры реакции. Влияние ингибитора на кинетику гидролиза этилового эфира N-бензоил-L-аргинина, катализируемого папаином. Условия опыта: рН 6,6; 25°С; ионная сила 0,3 М (KCl); 5×10-3 М цистеина; 1×10-3 М ЭДТА; [Е]0=1,2×10-6 М |
|
Вариант 6
В работе было продемонстрировано дезактивирующее действие ингибитора на реакцию превращения фенилэтиленоксида в фенилэтиленгликоль, катализируемую эпоксид-гидразой. На основании данных таблицы оценить значения кинетических и равновесных параметров реакции.
Влияние на гидратацию стирол-оксида, катализируемую эпоксид-гидразой. Условия опыта: рН 9,0; 37°С
| [ингибитор]×103, М | [S]0×104, M | v, усл. ед. |
| 2,0 | 2,5 2,0 1,5 1,0 | 1,59 1,35 1,08 0,76 |
| 0,25 | 2,5 2,0 1,5 1,0 | 1,84 1,52 1,18 0,81 |
| 2,5 2,0 1,5 1,0 | 2,00 1,63 1,24 0,843 |
Вариант 7
При изучении кинетики гидролиза пептидного субстрата, катализируемого карбоксипептидазой В, был обнаружен дезактивирующий эффект добавок ингибитора. Исходя из данных таблицы, рассчитать значения кинетических параметров реакции.
Влияние ингибитора на кинетику гидролиза гиппурил-L-аргинина, катализируемого карбоксипептидазой В. Условия опыта: рН 8,0; 23°С; трис-ацетатный буфер (0,025 М); [Е]0=1,21×10-4 мг/мл
| [ингибитор], М | [S]0×104, M | V×105, M×мин |
| 0,33 | 10,0 1,5 1,0 0,67 0,50 | 1,42 0,862 0,709 0,568 0,444 |
| 0,04 | 10,0 1,5 1,0 0,67 0,50 | 3,0 1,47 1,29 1,053 0,877 |
| 10,0 1,5 1,0 0,67 0,50 | 5,263 3,135 2,639 2,105 1,739 |
Вариант 8
Кофермент А (СоА) является ингибитором реакции, катализируемой фосфат-ацетилтрансферазой:
Ацетил-СоА + фосфат ® Ацетилфосфат + СоА
В таблице приведены данные по влиянию СоА на начальную скорость реакции при вариации концентрации субстрата. Определить тип ингибирования коферментом по отношению к неорганическому субстрату и вычислить кинетические параметры исследуемого процесса. Условия опыта: рН 8,32; 25°С; ионная сила 0,3 М; [Е]0=5×10-8 М
| [СоА]×104, М | [фосфат]×105, М | v×105, М×мин-1 |
| 10,0 5,00 2,50 2,00 1,67 | 13,33 11,76 9,09 8,13 7,41 | |
| 1,5 | 10,0 5,00 2,50 2,00 1,67 | 5,35 4,60 3,60 3,21 2,98 |
| 3,0 | 10,0 5,00 2,50 2,00 1,67 | 3,56 3,1 2,41 2,18 2,00 |
Вариант 9
|
|
|
| [ингибитор], М | [S]0×104, M | V×105, M×мин |
| 0,50 0,67 1,0 1,5 10,0 | 1,739 2,105 2,639 3,135 5,263 | |
| 0,025 | 0,50 0,67 1,0 1,5 10,0 | 1,115 1,449 1,821 2,247 3,37 |
| 0,1 | 0,50 0,67 1,0 1,5 10,0 | 0,72 0,889 1,111 1,333 2,15 |
| 0,33 | 0,50 0,67 1,0 1,5 10,0 | 0,444 0,568 0,709 0,862 1,42 |
При изучении кинетики гидролиза пептидного субстрата, катализируемого карбоксипептидазой В, был обнаружен дезактивирующий эффект добавок ингибитора. Исходя из данных таблицы, рассчитать значения кинетических параметров реакции
Условия опыта: рН 8,0; 23°С; трис-ацетатный буфер (0,025 М); [Е]0=1,21×10-4 мг/мл


 РАЗДЕЛ ІІ. ИЗУЧЕНИЕ ДИНАМИЧЕСКИХ МОДЕЛЕЙ БИОЛОГИЧЕСКИХПРОЦЕССОВ
РАЗДЕЛ ІІ. ИЗУЧЕНИЕ ДИНАМИЧЕСКИХ МОДЕЛЕЙ БИОЛОГИЧЕСКИХПРОЦЕССОВ
 2015-05-13
2015-05-13 788
788







