Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов.
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве «элементов» рассматривали четыре «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно, они образовывали четыре «начала» всех вещей – огонь, воздух, воду и землю. В средние века к этим началам добавились соль, сера и ртуть. В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
В настоящее время понятие «химический элемент»– вид атомов с одинаковым положительным зарядом ядра. (Последний равен порядковому номеру элемента в таблице Менделеева.)
В настоящее время известно 107 элементов. Около 90 из них существуют в природе. Остальные получены искусственно с помощью ядерных реакций. Все элементы делятся на металлы и неметаллы. К неметаллам относят следующие элементы: гелий, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, кислород, сера, селен, теллур, азот, фосфор, мышьяк, углерод, кремний, бор, водород. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
Неметаллические элементы в основном расположены в правой верхней части периодической системы. Так как в периодах слева направо у атомов элементов увеличивается заряды ядер и уменьшаются атомные радиусы, а в группах сверху вниз атомные радиусы также возрастают, то понятно, почему атому неметаллов сильнее, чем атомы металлов, притягивают наружные электроны. В связи с этим у неметаллов преобладают окислительные свойства. Особенно сильные окислительные свойства, т.е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Самым сильным окислителем является фтор. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличивается в следующем порядке: Si, B, H, P, C, S, I, N, Cl, O, F. Следовательно, энергичнее всего взаимодействует с водородом и металлами фтор:
H2 + F2 = 2HF
Менее энергично реагирует кислород:
2H2 +O2 = 2H2 О
Фтор – самый типичный неметалл, которому нехарактерны восстановительные свойства, т.е. способность отдавать электроны в химических реакциях.
Кислород же, судя по его соединениям с фтором, может проявлять и положительную степень окисления, т.е. являться восстановителем.
Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это H2, F2, Cl2, Br2, I2 (элементы VII группы Периодической системы), а также кислород O2 и азот N2. Из трехатомных молекул состоит газ озон (O3).
С водородом неметаллы образуют летучие соединения, как, например, фтороводород HF, сероводород H2S, аммиак NH3, метан CH4. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
При растворении в воде аммиака образуются аммиачная вода, обычно обозначаемая формулой NH4OH и называемая гидроксидом аммония. Ее также обозначают формулой NH3 • H2O и называют гидратом аммиака.
Если сравнить расположение электронов по орбиталям у атомав фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления – 1. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали. Благодаря этому распаривание электронов может произойти тремя разными путями.
В первом случае хлор может проявить степень окисления +3 и образовать хлористую кислоту HClO2, которой соответствуют соли – хлориты, например хлорит калия KClO2.
Во втором случае хлор может образовать соединения, в которых степень окисления хлора +5. К таким соединениям относятся хлороноватая кислота HClO3 и ее соли – хлораты, например хлорат калия КClO3 (бертолетова соль).
В третьем случае хлор проявляет степень окисления +7, например в хлорной кислоте HClO4 и в ее солях – перхлоратах, например в перхлорате калия КClO4.
С металлами водород образует (за некоторым исключением) нелетучие соединения, которые являются твердыми веществами немолекулярного строения. Поэтому их температуры плавления сравнительно высоки.
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
В периодах слева направо кислотные свойства летучих водородных соединений неметаллов в водных растворах усиливается. Это объясняется тем, что ионы кислорода имеют свободные электронные пары, а ионы водорода – свободную орбиталь, то происходит процесс, котроый выглядит следующим образом:
H2O + HF = H3O + F
Фтороводород в водном растворе отщепляет положительные ионы водорода, т.е. проявляет кислотные свойства. Этому процессу способствует и другое обстоятельство: ион кислорода имеет неподеленную электронную пару, а ион водорода – свободную орбиталь, благодаря чему образуется донорно-акцепторная связь.
При растворении аммиака в воде происходит противоположный процесс. А так как ионы азота имеют неподеленную электронную пару, а ионы водорода – свободную орбиталь, возникает дополнительная связь и образуются ионы аммония NH4+ и гидроксид-ионы ОН-. В результате раствор приобретает основные свойства. Этот процесс можно выразить формулой:
H2O + NH3 = NH4 + OH
Молекулы аммиака в водном растворе присоединяют положительные ионы водорода, т.е. аммиак проявляет основные свойства.
Теперь рассмотрим, почему водородное соединение фтора – фтороводород HF – в водном растворе является кислотой, но более слабой, чем хлороводородная. Это объясняется тем, что радиусы ионов фтора значительно меньше, чем ионов хлора. Поэтому ионы фтора гораздо сильнее притягивают к себе ионы водорода, чем ионы хлора. В связи с этим степень диссоциации фтороводородной кислоты значительно меньше, чем соляной кислоты, т.е. фтороводородная кислота слабее соляной кислоты.
Из приведенных примеров можно сделать следующие общие выводы:
1. В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
2. В группах сверху вниз отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+. В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
3. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
4. Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путем нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем отдача электронов облегчается.
2. Карбоновые кислоты - органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
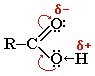 |
Карбоксильная группа сочетает в себе две функциональные группы - карбонил и гидроксил, взаимно влияющие друг на друга:
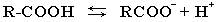 |
Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н.
В водном растворе карбоновые кислоты диссоциируют на ионы:
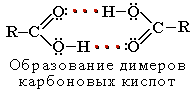 |
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
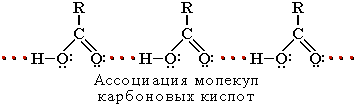 |
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
По числу карбоксильных групп кислоты подразделяются на одноосновные (монокарбоновые) и многоосновные (дикарбоновые, трикарбоновые и т.д.).
По характеру углеводородного радикала различают кислоты предельные, непредельные и ароматические.
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота. Часто используются также тривиальные названия.
 2015-05-13
2015-05-13 1536
1536








