Альдегидную группу в органических соединениях можно обнаружить с помощью таких реакций, как взаимодействие со свежеосажденным гидроксидом меди(II) при нагревании,
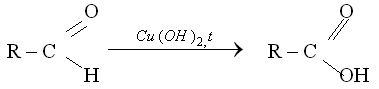
С аммиачным раствором оксида серебра (реакция серебряного зеркала).
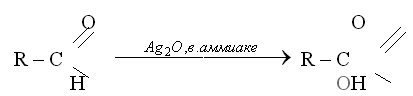
Эти реакции позволяют отличить альдегиды от кетонов.
При взаимодействии альдегида с гидроксидом меди (II) наблюдается образование кирпично-красного осадка оксида меди(I), а в реакции серебряного зеркала на стенках пробирки или колбы, в которой проводится эксперимент, образуется налет металлического серебра.
Впервые эта реакция была предложена немецким химиком Ю. Либихом.
Изучением свойств альдегидов занимался выдающийся русский химик и композитор, автор знаменитой “Богатырской симфонии” и всемирно известной оперы “Князь Игорь” Александр Порфирьевич Бородин. В 1872 г. он обнаружил, что при действии металлического натрия на альдегиды образуются не только продукты их диспропорционирования (спирт и карбоновая кислота), но также вещества с удвоенной: по сравнению с альдегидом молекулярной массой. Детальное исследование необычного продукта привело ученого к выводу, что вещество содержит одновременно и альдегидную, и гидроксильную группы, т. е. является алъдегидоспиртом (альдолем).
По химическому строению альдоль представлял собой продукт присоединения одной молекулы альдегида к другой:
Открытая А. П. Бородиным реакция получила название альдольной конденсации. Она протекает в щелочной среде и широко используется в промышленности для получения синкретического каучука, смол, лаков и душистых веществ.
Характерные реакции для альдегидов— присоединение по реакционно-способной карбонильной группе
Чем больше поляризована эта группа, тем легче идут реакции присоединения.
Для формальдегида такая тенденция проявляется особенно ярко, так как карбонильная группа в молекуле формальдегида поляризована в наибольшей степени по сравнению с другими членами гомологического ряда альдегидов.
Являясь альдегидом, формальдегид может восстанавливаться до соответствующего спирта (метилового) и окисляться до соответствующей кислоты (муравьиной).
Очень интересное соединение — уротропин. Впервые оно было..получено А. М. Бутлеровым в 50-х гг. XIX в. при действии на формальдегид аммиаком. Молекулярная формула вещества (СН2)6N4 определила его химическое название — гексаметилентетрамин. Структура вещества
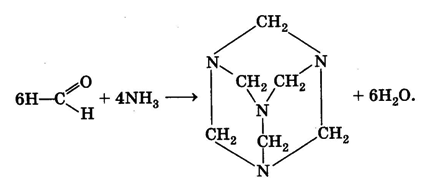
При нагревании в присутствии кислот уротропин вновь разлагается на аммиак и формальдегид. Это его свойство позволяет использовать уротропин в медицине в качестве антисептического средства. В организме человека он медленно гидролизуется, выделяющийся формальдегид уничтожает болезнетворные микроорганизмы. На том же свойстве основано применение препарата кальцекс, представляющего собой комплекс уротропина с хлоридом кальция.
Большое количество формальдегида используется для производства фенолоформальдегидных смол. Их смешивают с различными наполнителями и изготавливают пластмассы, называемые фенопластами. При растворении фенолоформаль-дегидных смол в ацетоне или спирте получают лаки/
При взаимодействии формальдегида с карбамидом {мочевиной) (NН2)2СО получают карбамидную смолу, а из нее — амино-пласты. Из этой пластмассы изготавливают электротехнические изделия (выключатели, розетки), материалы для отделки мебели и интерьеров, древесностружечные плиты, искусственный мрамор, тепло- и звукоизоляционные пористые материалы.
Большое количество формальдегида используется в органическом синтезе для производства лекарственных веществ, красителей.
Широко применяется 40%-ный водный раствор формальдегида — формалин. Его использование связано со способностью свертывать белок. Так, например, в кожевенном производстве в результате дубильного действия формалина кожа твердеет и не подвергается гниению. На том же свойстве основано применение формалина для хранения биологических препаратов. Формалин используется для дезинфекции и протравливания семян.
Задача. При сгорании 2,3 г вещества образуется 4,4 г оксида углерода (IV) и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определите молекулярную формулу данного вещества.

Билет 13
 2015-05-13
2015-05-13 16372
16372
