| Формула | Название | |
| систематическое | тривиальное | |
| HCOOH | метановая | муравьиная |
| CH3COOH | этановая | уксусная |
| C2H5COOH | пропановая | пропионовая |
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
2.1 Образование солей
а) при взаимодействии с металлами:
2RCOOH + Mg = (RCOO)2Mg + H2
б) в реакциях с гидроксидами металлов:
2RCOOH + NaOH = RCOONa + H2O
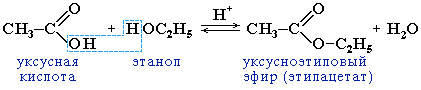 |
2.2 Образование сложных эфиров R'–COOR":
Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации
2.3 Образование амидов:
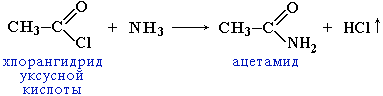 |
Вместо карбоновых кислот чаще используют их галогенангидриды:
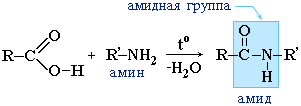
Промышленный синтез уксусной кислоты: СН 2 – СООН
a) каталитическое окисление бутана
2CH3–CH2–CH2–CH3 + 5O2 t  4CH3COOH + 2H2O
4CH3COOH + 2H2O
b) нагреванием смеси оксида углерода (II) и метанола на катализаторе под давлением
CH3OH + CO 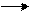 CH3COOH
CH3COOH
Производство уксусной кислоты брожением (уксуснокислое брожение).
Сырье: этанолсожержащие жидкости (вино, забродившие соки), кислород.
Вспомогательные вещества: ферменты уксуснокислых бактерий.
Химическая реакция: этанол биокаталитически окисляется до уксусной кислоты.
СН 2 – СН – ОН + О 2  СН 2 – СООН + Н 2 О
СН 2 – СООН + Н 2 О
Применение уксусной кислоты
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетата целлюлозы), в виде столового уксуса при изготовлении приправ, маринадов, консервов.
Водный раствор уксусной кислоты используют в качестве вкусового и консервирующего средства (приправа к пище, маринование грибов, овощей).
В состав уксуса входят такие кислоты, как яблочная, молочная, аскорбиновая, уксусная.
Яблочный уксус(4% уксусной кислоты)
Здоровым людям рекомендуется каждый день употреблять полезный и освежающий напиток: в стакане воды размешать ложку меда и добавить 1 ложку яблочного уксуса. Желающим похудеть, рекомендуем каждый раз во время еды выпивать стакан несладкой воды с двумя ложками яблочного уксуса.
Уксус широко используется в домашнем консервировании для приготовления маринадов различной крепости. В народной медицине уксус используется как неспецифическое жаропонижающее средство (путем протирания кожи раствором воды и уксуса в пропорции 3:1), а также при головных болях методом примочек. Распространено применение уксуса при укусах насекомых посредством компрессов.
Известно применение спиртового уксуса в косметологии. А именно для придания мягкости и блеска волосам после химической завивки и перманентной окраски. Для этого волосы рекомендуется ополаскивать теплой водой с добавлением спиртового уксуса (на 1 литр воды - 3-4 ложки уксуса).
Уксусная кислота применяется также для производства лекарственных средств.
Таблетки Аспирина (ЭС) содержат активный ингредиент ацетилсалициловую кислоту, которая представляет собой уксусный эфир салициловой кислоты.
Ацетилсалициловая кислота производится путём нагревания салициловой кислоты с безводной уксусной кислотой в присутствии небольшого количества серной кислоты (в качестве катализатора).
Уксусная кислота используется в и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров), в производстве негорючих пленок, парфюмерных продуктов, растворителей, при синтезе красителей, лекарственных веществ, например, аспирина. Соли уксусной кислоты используют для борьбы с вредителями растений.
3. Опыт. Проведение реакций, подтверждающих качественный состав данного неорганического вещества.
Окрашивание пламени (предварительная проба)
| Элемент | Литий | Натрий | Калий | Кальций | Барий | Медь |
| Окраска пламени | Красный | Желтый | Фиолетовый | Кирпично-красный | Желто-зеленый | Зеленый |
Реакции осаждения
| Катион или анион | Реактив | Наблюдаемая реакция |
| Са2+ | СО32_ | Са2+ + СО32- → СаСО3↓ белый осадок |
| Ва2+ | SO42- | Ва2+ + SO42- → BaSO4↓ белый мелкокристаллический осадок |
| Сu2+ | щелочь OH- | Сu2+ + 2OH- → Cu(OH)2↓ синий осадок |
| Ag+ | Cl- | Ag+ + Cl- → AgCl↓ белый (творожистый) осадок |
| Fe2+ | щелочь OH- красная кровяная соль K4[Fe(CN)6] | Fe2+ + OH- → Fe(OH)2↓ зеленоватый осадок Fe2+ + [Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ синий осадок |
| Fe3+ | щелочь ОН- желтая кровяная соль K4[Fe(CN)6] | Fe3+ + ОН- → Fe(OH)3 ↓ бурый осадок Fe3+ + [Fe(CN)6]2-→ Fe4[Fe(CN)6]3↓ синий осадок |
| SO42- | Ba2+ | SO42- + Ba2+ → BaSO4↓ белый осадок |
| СО32- | растворы кислот Н+ | СО32- + Н+ → Н2О + СО2↑ выделение газа без запаха, вызывающего помутнение известковой воды |
| Cl- | нитрат серебра Ag+ | Cl- + Ag+ → AgCl↓ белый (творожистый) осадок |
| Br- | нитрат серебра Ag+ | Br- + Ag+ → AgBr↓ желтоватый осадок |
Цветные реакции
| Определяемый ион | Реактив | Отличительный признак реакции (цвет раствора) |
| Катион водорода Н+ | Лакмус Метилоранж | Красный Красный |
| Гидроксид – анион ОН- | Лакмус Метилоранж Фенолфталеин | Синий Желтый Малиновый |
Реакции с выделением газа
| Определяемый ион | Реактив | Признак реакции |
| Катион аммония NH4+ | Раствор щелочи ОН- | Выделение аммиака NH4+ + OH- → NH3↑ + H2O резкий запах |
| Карбонат – анион СО32- | Соляная кислота Н+ | Выделение оксида углерода (IY) H+ + CO32- → CO2↑ + H2O бесцветный газ |
 2015-05-13
2015-05-13 1020
1020