КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современная классификация ферментов разработана Международным биохимическим союзом (1961г.). В ее основу положен тип катализируемой реакции и механизм. Все ферменты делят на шесть классов: I. Оксидоредуктазы. II. Трансферазы. III. Гидролазы. IV. Лиазы. V. Изомеразы. VI. Лигазы.
Каждый фермент имеет кодовый номер по классификации ферментов: первая цифра характеризует класс реакции, вторая − подкласс, третья − подподкласс, четвертая цифра указывает порядковый номер фермента в его подподклассе. Название фермента состоит из двух частей: в первой части − название субстрата (или субстратов), во второй − тип катализируемой реакции.
Оксидоредуктазы
Оксидоредуктазы катализируют окислительно-восстановительные реакции и подразделяются на 5 основных подклассов:
- оксидазы;
- аэробные дегидрогеназы;
- анаэробные дегидрогеназы;
- гидропероксидазы;
- оксигеназы.
Оксидазы. Катализируют удаление водорода из субстрата, используя при этом в качестве акцептора водорода только кислород. Оксидазы содержат медь, продуктом реакции является вода (исключение составляют реакции, катализируемые уриказой и моноаминоксидазой, в результате которых образуется Н2О2).
Общая схема процесса следующая:
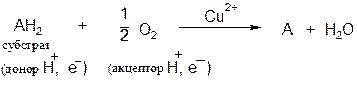
В качестве субстратов оксидаз могут выступать фенолы, полифенолы, амины. Примерами ферментов класса оксидаз являются фенолаза, цитохром-оксидаза, моноаминоксидаза, уриказа.
Фенолаза (катехолоксидаза, тирозиназа) − медьсодержащий фермент с широкой специфичностью. Он катализирует превращение монофенола
(в присутствии о-дифенола) в орто-хинон. Медь содержится также в уриказе, катализирующей окисление мочевой кислоты в аллантоин, и в моноаминоксидазе, окисляющей адреналин и тирамин в митохондриях.
Цитохромоксидаза − гемопротеин, который служит конечным компонентом дыхательной цепи и осуществляет перенос электронов на конечный акцептор − кислород. Данный фермент ингибируется оксидом углерода (II), цианидами и сероводородом. Фермент содержит две молекулы гема, в каждой из которых атом железа может переходить из состояния Fe2+ в состояние Fe3+ и обратно в ходе окисления и восстановления, а также два атома Сu, каждый из которых взаимодействует с одним из гемов.
Аэробные дегидрогеназы. Катализируют удаление водорода из суб-страта, используя в качестве акцептора водорода не только кислород, но и искусственные акцепторы (например, метиленовый синий). Эти дегидрогеназы относятся к флавопротеинам.
В результате реакции образуется пероксид водорода, а не вода:
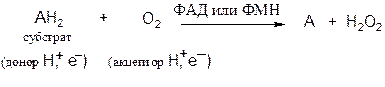
В качестве кофермента дегидрогеназы содержат ФАД (флавинаденин-динуклеотид) или ФМН (флавинмононуклеотид). Многие флавопротеиновые ферменты содержат несколько ионов металлов.
К ферментам группы аэробных дегидрогеназ относятся: дегидрогеназа L- аминокислот (оксидаза L- аминокислот), катализирующая окислительное дезаминирование природных L- аминокислот, и ксантиндегидрогеназа (ксантиноксидаза), катализирующая окисление ксантина в мочевую кислоту. Молибденсодержащий фермент ксантиноксидаза играет важную роль в катаболизме пуриновых оснований.
Анаэробные дегидрогеназы. Катализируют удаление водорода из субстрата, но не способны использовать кислород в качестве акцептора.
О бщая схема процесса следующая:
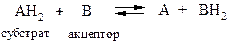
Анаэробные дегидрогеназы подразделяются в зависимости от природы кофермента на несколько групп.
НАД+-зависимые (пиридинзависимые, первичные) дегидрогеназы, содержащие в качестве кофермента НАД+ или НАДФ+. В общем случае НАД+-зависимые дегидрогеназы катализируют окислительно-восстановительные реакции специфических (например, гликолиза) и общих путей катаболизма (например, цикла Кребса, дыхательной цепи).
Общая схема процесса следующая:
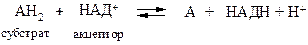
Примером НАД+-зависимых дегидрогеназ могут служить лактатдегидрогеназа, алкогольдегидрогеназа, глутаматдегидрогеназа и др. Например, 1.1.1.27 L -лактат: НАД+-оксидоредуктаза (лактатдегидрогеназа) катализирует взаимопревращение лактата и пирувата:
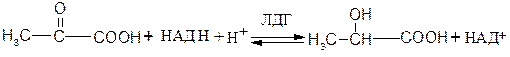
Пируват L - Лактат
ФАД- и ФМН- зависимые анаэробные дегидрогеназы (флавин-зависимые дегидрогеназы). Первичные флавинзависимые дегидрогеназы переносят восстановительные эквиваленты от субстрата непосредственно на дыхательную цепь. К ним относятся, например, 1.3.99.1 сукцинатдегидрогеназа (СДГ), ацил-КоА-дегидрогеназа и митохондриальная глицерол-3-фосфат-дегидрогеназа:
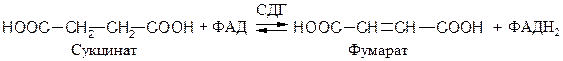
Вторичная ФМН-зависимая НАДН-дегидрогеназа − компонент дыхательной цепи, переносящий электроны от НАДН к более электроположительным компонентам:
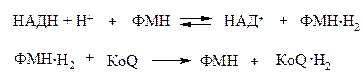
Еще одна функция флавинзависимых дегидрогеназ − катализируемое дигидролипоилдегидрогеназой дегидрирование восстановленного липоата
(промежуточного продукта при окислительном декарбоксилировании пирувата и a -кетоглутарата). При этом вследствие низкого значения окислительно-восстановительного потенциала системы липоата переносчиком водорода от восстановленного липоата к НАД+ является флавопротеин (ФАД).
Цитохромы за исключением цитохромоксидазы классифицируются как анаэробные дегидрогеназы. В дыхательной цепи они служат переносчиками электронов от флавопротеинов к цитохромоксидазе. Цитохромы являются гемопротеинами, у которых атом железа переходит из состояния Fe2+ в Fe3+ и обратно в процессе окисления и восстановления. Помимо дыхательной цепи цитохромы имеются в эндоплазматическом ретикулуме (цитохромы Р-450 и b-5).
Гидропероксидазы. К их числу относятся ферменты пероксидаза и каталаза.
Пероксидаза − фермент, катализирующий окисление пероксидом водорода различных органических соединений − фенолов, аминов, аскорбиновой кислоты, цитохрома С. Пероксидаза обнаружена в растениях, молоке, лейкоцитах, тромбоцитах, а также в тканях, в которых происходит метаболизм эйкозаноидов. Фермент содержит протогем, который в отличие от гемовых групп большинства гемопротеинов слабо связан с апоферментом.
Реакция, катализируемая пероксидазой, имеет сложный характер; суммарная реакция выглядит следующим образом:
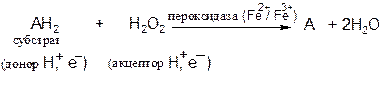
В эритроцитах глутатионпероксидаза, содержащая в качестве простетической группы селен, катализирует разложение Н2О2 и гидропероксидов липидов восстановленным глутатионом и, таким образом, защищает липиды мембран и гемоглобин от окисления пероксидами.
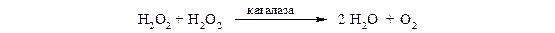 |
Каталаза − это гемопротеин, содержащий 4 гемовые группы. Наряду с пероксидазной активностью каталаза способна использовать одну молекулу Н2О2 в качестве донора электронов, а другую − в качестве акцептора электронов. В организме каталаза в основном разлагает пероксид водорода, образующийся при действии аэробных дегидрогеназ:
Каталаза содержится в крови, костном мозге, мембранах слизистых оболочек, почках и печени.
Во многих тканях, включая и печень, обнаружены микротельца − пероксисомы, которые богаты аэробными дегидрогеназами и каталазой. Биологически выгодно группировать в одном месте как ферменты, приводящие к образованию Н2О2, так и ферменты, разлагающие это соединение.
К ферментам, катализирующим образование Н2О2, кроме пероксисомных ферментов, относятся также митохондриальные и микросомные системы транспорта электронов.
Оксигеназы.
Ферменты этой группы катализируют включение кисло-рода в молекулу субстрата, которое происходит в две стадии:
1) кислород связывается с активным центром фермента;
2) происходит реакция, в результате которой, связанный кислород восстанавливается или переносится на субстрат.
Оксигеназы не относятся к ферментам, которые катализируют реакции, снабжающие клетку энергией; они участвуют в синтезе и деградации многих типов метаболитов, токсинов и ксенобиотиков. Оксигеназы подразделяются на 2 подгруппы.
Монооксигеназы (гидроксилазы). Эти ферменты катализируют включение в субстрат только одного из атомов молекулы кислорода. Другой атом кислорода восстанавливается до воды; для чего необходим дополнительный донор электронов (косубстрат):
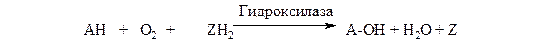
субстрат косубстрат
Природа косубстрата может быть различной. Многие оксигеназы используют НАДФН2. В этом случае суммарное уравнение реакции можно записать как
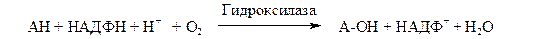 К подобным системам относятся микросомные цитохром-Р-450-содержащие монооксигеназные системы, участвующие в метаболизме многих лекарственных веществ путем их гидроксилирования. Они находятся в микросомах печени вместе с цитохромом Р-450 и цитохромом b-5. Восстановителями этих цитохромов являются НАДН и НАДФН. Цитохромы окисляются субстратами в результате серии ферментативных реакций, составляющих так называемый гидроксилазный цикл:
К подобным системам относятся микросомные цитохром-Р-450-содержащие монооксигеназные системы, участвующие в метаболизме многих лекарственных веществ путем их гидроксилирования. Они находятся в микросомах печени вместе с цитохромом Р-450 и цитохромом b-5. Восстановителями этих цитохромов являются НАДН и НАДФН. Цитохромы окисляются субстратами в результате серии ферментативных реакций, составляющих так называемый гидроксилазный цикл:
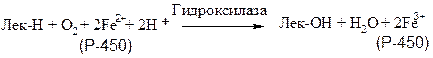
Лек - лекарственное вещество
К лекарственным веществам, метаболизм которых идет при участии рассматриваемых систем, относятся, например, морфин и бензпирен. Многие лекарственные вещества (например, фенобарбитал) способны индуцировать синтез микросомных ферментов и цитохрома Р-450. Цитохром Р-450 является одновременно гемо- и флавопротеином, причем флавиновые нуклеотиды выступают в качестве второго донора электронов. Цитохром Р-450 в печени осуществляет гидроксилирование липофильных соединений, образующихся в качестве побочных продуктов или попадающих в организм извне (такие вещества объединяют под общим названием «ксенобиотики»). Введение в их молекулы гидроксильных групп повышает гидрофильность этих веществ, понижает токсичность и облегчает их вывод из организма.
Другой пример подобных систем − митохондриальные цитохром-Р-450-содержащие монооксигеназные системы. Они находятся в коре надпочечников, семенниках, яичниках, плаценте, почках и участвуют в биосинтезе стероидных гормонов из холестерина, катализируют гидроксилирование гидроксихолекальциферола, что приводит к образованию активной формы витамина D3 (1,25-дигидроксихолекальциферола). В коре надпочечников содержание митохондриального цитохрома Р-450 в 6 раз выше, чем содержание цитохромов в дыхательной цепи.
Диоксигеназы (истинные оксигеназы). Эти ферменты катализируют включение в молекулу субстрата обоих атомов молекулы кислорода:
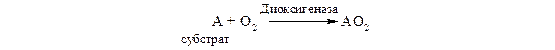
Примером служат железосодержащие ферменты 1.13.11.5 гомогентизатдиоксигеназа и 1.13.11.6 3-гидроксиантранилатдиоксигеназа, а также некоторые гемсодержащие ферменты, в частности триптофандиоксигеназа (триптофанпирролаза).
 2015-06-26
2015-06-26 33025
33025







