Родоначальником русской микробиологии является Л. Ценковский (1822-1887). Объектом его исследований были микроскопические простейшие, водоросли, грибы. Он открыл и описал большое число простейших, изучал их морфологию и циклы развития. Это позволило ему сделать вывод об отсутствии резкой границы между миром растений и животных. Им также была организована одна из первых Пастеровских станций в России и предложена вакцина против сибирской язвы («живая вакцина Ценковского»).
С именем И. Мечникова (1845-1916) связано развитие нового направления в микробиологии - иммунологии. Впервые в науке Мечниковым была разработана и экспериментально подтверждена биологическая теория иммунитета, вошедшая в историю как фагоцитарная теория Мечникова. В основу этой теории положено представление о клеточных защитных приспособлениях организма. Мечников в опытах на животных (дафниях, личинках морской звезды) доказал, что лейкоциты и другие клетки мезодермального происхождения обладают способностью захватывать и переваривать чужеродные частицы (в т.ч. и микробов), попадающие в организм. Это явление, названное фагоцитозом, легло в основу фагоцитарной теории иммунитета и получило всеобщее признание. Развивая далее поднятые вопросы, Мечников сформулировал общую теорию воспаления как защитную реакцию организма и создал новое направление в иммунологии - учение об антигенной специфичности. В настоящее время оно приобретает все большее значение в связи с разработкой проблемы пересадки органов и тканей, изучения иммунологии рака.
К числу важнейших работ Мечникова в области медицинской микробиологии относятся исследования патогенеза холеры и биологии холероподобных вибрионов, сифилиса, туберкулеза, возвратного тифа. Мечников является основоположником учения о микробном антагонизме, послужившем основой для развития науки об антибиотикотерапии. Идея о микробном антагонизме была использована Мечниковым при разработке проблемы долголетия. Изучая явление старения организма, Мечников пришел к заключению. Что важнейшей причиной его является хроническое отравление организма продуктами гниения, вырабатываемыми в толстом кишечнике гнилостными бактериями.
Практический интерес представляют ранние работы Мечникова по использованию гриба Isaria destructor для борьбы с вредителем полей - хлебным жуком. Они дают основание считать Мечникова основоположником биологического метода борьбы с вредителями сельскохозяйственных растений, метода, который в наши дни находит все более широкое применение и популярность. Таким образом, И.И. Мечников - выдающийся русский биолог, сочетавший качества экспериментатора, педагога и пропагандиста научных знаний, - был человеком великого духа и труда, высшей наградой которого явилось присвоение ему в 1909 г. Нобелевской премии за исследования по фагоцитозу. Развитие микробиологии в нашей стране тесно связано также с именем крупнейшего ученого, друга и соратника И. Мечникова, Н.Ф. Гамалеи (1859-1949). Всю свою жизнь Гамалея посвятил изучению инфекционных болезней и разработке мер борьбы с их возбудителями. Гамалея внес крупнейший вклад в изучение туберкулеза, холеры, бешенства, в 1886 г. вместе с И. Мечниковым организовал в Одессе первую пастеровскую станцию и ввел в практику прививки против бешенства. Он открыл птичий вибрион - возбудителя холероподобного заболевания птиц - и в честь Ильи Ильича назвал его вибрионом Мечникова. Затем была получена вакцина против холеры человека.
Большое внимание Гамалея уделял и вопросам эпидемиологии инфекционных болезней. Он был крупнейшим специалистом в области иммунологии. Разработав оригинальный метод получения оспенной вакцины, он впервые высказал идею о выделении из бактерий наиболее полноценных антигенов и об использовании их для приготовления так называемых химических вакцин. Гамалея первый наблюдал и описал явление спонтанного лизиса бактерий под влиянием неизвестного в то время агента - бактериофага. Поэтому Гамалея считается не только одним из основоположников медицинской микробиологии, но и иммунологии и вирусологии.
С.Н.Виноградского, В.Л. Омелянского, Б.Л. Исаченко, Д.И. Ивановского, Г.А. Надсона, явившихся основоположниками тех или иных направлений в общей микробиологии. Создание, например, учения об экологии почвенных микроорганизмов неразрывно связано с именем русского исследователя С. Виноградского (1856-1953). Виноградский внес большой вклад и в познание физиологического многообразия микробного мира. Им выполнены классические работы по физиологии серобактерий, железобактерий, результатом которых явилось открытие хемосинтеза у бактерий - величайшее открытие 19 в.
С. Виноградский доказал, что существуют бактерии, самостоятельно синтезирующие органическое вещество, используя при этом энергию окисления минеральных соединений (сероводород, аммиак) и углерод углекислоты, тт. е. был открыт новый тип питания микроорганизмов - автотрофизм.
Неизменным требованием Виноградского было исследование микроорганизмов в естественной среде обитания или условиях, максимально приближающихся к естественным. Следуя этому принципу, он разработал простые и оригинальные методы исследования почвенных микроорганизмов. Всеобщее признание и широкое применение получил метод элективных (избирательных) сред, позволивший выделить из естественной среды ряд новых микроорганизмов и определить их роль в круговороте веществ.
С. Виноградским опубликовано свыше 300 научных работ, посвященных экологии и физиологии почвенных микроорганизмов. Его по праву считают отцом почвенной микробиологии. К числу выдающихся основоположников отечественной микробиологии следует отнести также ученика С. Виноградского В.Л. Омалянского (1867-1928). Он был не только замечательным ученым, но и талантливым педагогом, популяризатором достижений микробиологии. В. Омелянский, подобно Пастеру, обладал глубокими знаниями в области химии, которые легли в основу его и экологического изучения микроорганизмов. Круг научных интересов В. Омелянского очень широк, однако главное направление его исследований связано с изучением круговорота веществ в природе, в котором существенную роль он отводил микроорганизмам. Изучая процессы разложения органического вещества, он впервые выделил целлюлозоразрушающие бактерии, описал их физиологию и химизм самого процесса.
Глубоко и всесторонне Омелянским были изучены микроорганизмы, участвующие в круговороте азота, особенно свободноживущие азотофиксаторы и нитрификаторы. К новой области исследований относится одна из последних работ Омелянского «Роль микроорганизмов в выветривании горных пород». Эта работа легла в основу геологической микробиологии.
Большой заслугой Омелянского является создание первого русского учебника «Основы микробиологии», вышедшего из печати в 1909 г. и выдержавшего 9 изданий. В нем Омелянский обобщил результаты микробиологических исследований и дал общие схемы круговорота в природе отдельных элементов, в том числе азота, углерода, серы и железа. В течение десятилетий этот учебник был настольной книгой специалистов.
Экологическое направление в микробиологии успешно разрабатывалось Б.Л. Исаченко (1871-1948). Всеобщую известность приобрели работы в области водной микробиологии. Он впервые исследовал распространение микроорганизмов в Северном Ледовитом океане и указал на их важную роль в геологических процессах и в круговороте веществ в водоемах.
Большой вклад в развитие отечественной и мировой микробиологии внес Д.И. Ивановский (1864-1920), открывший в 1892 г. вирусы растений и тем самым заложивши основу новой науки - вирусологии. Подчеркивая важность исследования Ивановского, английский вирусолог Н. Пири писал: «Огромное значение открытия Ивановского для теоретического естествознания заключается в том, что им была открыта новая форма существования белковых тел». Идеи Ивановского сыграли решающую роль в последующих блестящих успехах вирусологии, в результате которых были открыты возбудители большинства вирусных болезней человека, животных, растений и микроорганизмов. По заключению американского вирусолога Стенли, имя Ивановского в вирусологии следует рассматривать в том же свете, как имена Пастера и Коха в микробиологии.
10. Сферические формы (кокки) - шаровидные бактерии размером 0,5 - 1,0 мкм; по взаимнму расположению клеток различают микрококии, диплококки, стрептококки, тетракокки, сарцины и стафилококки.
Микрококки (лат. малый) - отдельно расположенные клетки или в виде "пакетов".
Диплококки (лат. двойной) - располагаются парами, так как клетки после деленияне расходятся.
Стрептококки (от греч. streptos - цепочка) - клетки округлой или продолговатой формы, составляющие цепочку вследствие деления клеток в одной плоскости и сохранения связи между ними в месте деления.
Сарцины (от лат. sarcina - связка, тюк) - располагаются в виде пакетов из 8-и и более кокков, так как они образуются при делении клетки в трех взаимно перпендикулярных плоскостях.
Стафилококки (от. греч. staphyle - виноградная гроздь) - кокки расположенные в виде грозди винограда в результате деления в различных плоскостях.
Палочковидные бактерии различаются пао размерам, форме концов клетки и взаимному расположению клеток. Длина клеток варьирует от 1,0 до 8,0, толщина от 0,5 до 2,0 мкм. Палочки могут быть правильной (кишечная палочка) и неправильной (коринебактерии) формы, в том числе ветвящиеся, например актиномицеты. Слегка изогнутые палочки называют вибрионами (холерный вибрион). Большинство палочковидных бактерий располагаются беспорядочно, так как после деления клетки расходятся.
Риккетсии - мелкие грамотрицательные палочковидные бактерии (0,3 - 2,0 мкм), облигатные внутриклеточные паразиты. Размножаются делением в цитоплазме, а некоторые - ядре инфицированных клеток. Обитают в организме членистоногих (вшей, блох, клещей), которые являются их хозяевами или переносчиками. Форма и размер риккетсий могут изменяться (клетки неправильной формы, нитевидные) в зависимости от условий роста. Структура риккетсии не отличается от таковой грамотрицательной бактерии.
Хламидии - относятся к облигатным внутриклеточным кокковым грамотрицательным (иногда грамвариабельным) бактериям. Вне клеток хламидии имеют сферическую форму (0,3 мкм), метаболически неактивны и называются элементарными тельцами. В клеточной стенке элементарных телец имеется главный белок наружной мембраны и белок, содержащий большое количество цистеина. Хламидии размножаются только в живых клетках, их рассматривают как энергетических паразитов.
Элементарные тельца попадают к эпителиальную клетку путем эндоцитоза с формированием внутриклеточной вакуоли. Внутри клетки они увеличиваются и превращаются в делящиесяретикулярные тельца, образуя скопления в вакуолях (включения). Из ретикулярных телец образуются элементарные тельца, которые выходят из клеток путем экзоцитоза или лизиса клетки.
Микоплазмы - мелкие бактерии (0,15 - 1,0 мкм), окруженные цитоплазматической мембраной и не имеющие клеточной стенки. Из-за отсутствия клеточной стенки микоплазмы осмотически чувствительны. Имеют разнообразную форму: кокковидную, нитевидную, колбовидную. Эти формы видны при фазово-контрастной микроскопии чистых культур микоплазм. Патогенные микоплазмы вызывают хронические инфекции - микоплазмозы.
Актиномицеты - ветвящиеся, нитевидные или палочковидные грамположительные бактерии. Свое название (от греч. actis - луч, mykes - гриб) они получили всвязи с образованием в пораженных тканях друз - гранул из плотно переплетенных нитей в виде лучей, отходящих от центра и заканчивающихся колбовидными утолщениями. Актиномицеты могут делиться путем фрагментации мицелия на клетки, похожие на палочковидные и кокковидные бактерии. На воздушных гифах актиномицетов могут образовываться споры, служащие для размножения. Споры актиномицетов обычно нетермостойки.
Общую филогенетическую ветвь с актиномицетами образуют так называемые нокарднеподобные (нокардиоформные) актиномицеты — собирательная группа палочковидных, неправильной формы бактерий. Их отдельные представители образуют ветвящиеся формы. К ним относят бактерии родов Corynebacterium, bdycobacterium, Hocardia и др.
Нокардиоподобные актиномицеты отличаются наличием в клеточной стенке Сахаров арабинозы, галактозы, а также миколовых кислот и больших количеств жирных кислот. Миколовые кислоты и липиды клеточных стенок обусловливают кислотоустойчивость бактерий, в частности, микобактерий туберкулеза и лепры (при окраске по Цилю-Нельсену они имеют красный цвет, а некислотоустойчивые бактерии и элементы ткани, мокроты - синий цвет).
Извитые формы - спиралевидные бактерии, например спириллы, имеющие вид штопорообразно извитых клеток. К патогенным спириллам относится возбудитель содоку (болезнь укуса крыс). К извитым также относятся кампилобактеры, хеликобактеры, имеющие изгибы как у крыла летящей чайки; близки к ним и такие бактерии, как спирохеты.
Спирохеты — тонкие, длинные, извитые (спиралевидной формы) бактерии, отличающиеся от спирилл подвижностью, обусловленной сгибательными изменениями клеток. Спирохеты имеют наружную мембрану клеточной стенки, окружающую протоплазматический цилиндр с цитоплазматической мембраной. Под наружной мембраной клеточной стенки (в периплазме) расположены периплазматические фибриллы (жгутики), которые как бы закручиваясь вокруг протоплазматического цилиндра спирохеты, придают ей винтообразную форму (первичные завитки спирохет). Фибриллы прикреплены к концам клетки и направлены навстречу друг другу. Другой конец фибрилл свободен. Число и расположение фибрилл варьируют у разных видов. Фибриллы участвуют в передвижении спирохет, придавая клеткам вращательное, сгибательное и поступательное движение. При этом спирохеты образуют петли, завитки, изгибы, которые названы вторичными завитками.
Спирохеты плохо воспринимают красители. Их окрашивают по методу Романовского—Гимзы или серебрением, а в живом виде исследуют с помощью разово-контрастнои или темнопольнои микроскопии.
Лептоспиры (род Leptospira) имеют завитки неглубокие и частые — в виде закрученной веревки. Концы этих спирохет изогнуты наподобие крючков с утолщениями на концах. Образуя вторичные завитки, они приобретают вид букв S или С; имеют 2 осевые нити. Патогенный представитель L. interrogates вызывает лептоспироз.
Размеры бактерий в среднем составляют 0,5—5 мкм. Escherichia coli, например, имеет размеры 0,3—1 на 1—6 мкм, Staphylococcus aureus — диаметр 0,5—1 мкм, Bacillus subtilis 0,75 на 2—3 мкм. Крупнейшей из известных бактерий является Thiomargarita namibiensis, достигающая размера в 750 мкм (0,75 мм). Второй является Epulopiscium fishelsoni имеющая диаметр 80 мкм и длину до 700 мкм и обитающая в пищеварительном тракте хирурговой рыбы Acanthurus nigrofuscus. Achromatium oxaliferum достигает размеров 33 на 100 мкм, Beggiatoa alba — 10 на 50 мкм. Спирохеты могут вырастать в длину до 250 мкм при толщине 0,7 мкм. В то же время к бактериям относятся самые мелкие из имеющих клеточное строение организмов. Mycoplasma mycoides имеет размеры 0,1—0,25 мкм, что соответствует размеру крупных вирусов, например, табачной мозаики, коровьей оспы или гриппа. По теоретическим подсчётам сферическая клетка диаметром менее 0,15—0,20 мкм становится неспособной к самостоятельному воспроизведению, поскольку в ней физически не помещаются все необходимые биополимеры и структуры в достаточном количестве.
Однако были описаны нанобактерии, имеющие размеры меньше «допустимых» и сильно отличающиеся от обычных бактерий. Они, в отличие от вирусов, способны к самостоятельному росту и размножению (чрезвычайно медленным). Они пока мало изучены, живая их природа ставится под сомнение.
При линейном увеличении радиуса клетки её поверхность возрастает пропорционально квадрату радиуса, а объём — пропорционально кубу, поэтому у мелких организмов отношение поверхности к объёму выше, чем у более крупных, что означает для первых более активный обмен веществ с окружающей средой. Метаболическая активность, измеренная по разным показателям, на единицу биомассы у мелких форм выше, чем у крупных. Поэтому небольшие даже для микроорганизмов размеры дают бактериям и археям преимущества в скорости роста и размножения по сравнению с более сложноорганизованными эукариотами и определяют их важную экологическую роль.
11. Общая схема строения бактериальной клетки показана на рисунке 2. Внутренняя организация бактериальной клетки сложна. Каждая систематическая группа микроорганизмов имеет свои специфические особенности строения.
Клеточная стенка. Клетка бактерий одета плотной оболочкой. Этот поверхностный слой, расположенный снаружи от цитоплазматической мембраны, называют клеточной стенкой (рис. 2, 14). Стенка выполняет защитную и опорную функции, а также придает клетке постоянную, характерную для нее форму (например, форму палочки или кокка) и представляет собой наружный скелет клетки. Эта плотная оболочка роднит бактерии с растительными клетками, что отличает их от животных клеток, имеющих мягкие оболочки. Внутри бактериальной клетки осмотическое давление в несколько раз, а иногда и в десятки раз выше, чем во внешней среде. Поэтому клетка быстро разорвалась бы, если бы она не была защищена такой плотной, жесткой структурой, как клеточная стенка.
Толщина клеточной стенки 0,01—0,04 мкм. Она составляет от 10 до 50% сухой массы бактерий. Количество материала, из которого построена клеточная стенка, изменяется в течение роста бактерий и обычно увеличивается с возрастом.
Основным структурным компонентом стенок, основой их жесткой структуры почти у всех исследованных до настоящего времени бактерий является муреин (гликопептид, мукопептид). Это органическое соединение сложного строения, в состав которого входят сахара, несущие азот,— аминосахара и 4—5 аминокислот. Причем аминокислоты клеточных стенок имеют необычную форму (D-стереоизомеры), которая в природе редко встречается.
Составные части клеточной стенки, ее компоненты, образуют сложную прочную структуру.
С помощью способа окраски, впервые предложенного в 1884 г. Кристианом Грамом, бактерии могут быть разделены на две группы:грамположительные и грамотрицательные. Грамположительные организмы способны связывать некоторые анилиновые красители, такие, как кристаллический фиолетовый, и после обработки иодом, а затем спиртом (или ацетоном) сохранять комплекс иод-краситель. Те же бактерии, у которых под влиянием этилового спирта этот комплекс разрушается (клетки обесцвечиваются), относятся к грамотрицательным.
Химический состав клеточных стенок грамположительных и грамотрицательных бактерий различен.
У грамположительных бактерий в состав клеточных стенок входят, кроме мукопептидов, полисахариды (сложные, высокомолекулярные сахара), тейхоевые кислоты (сложные по составу и структуре соединения, состоящие из сахаров, спиртов, аминокислот и фосфорной кислоты). Полисахариды и тейхоевые кислоты связаны с каркасом стенок — муреином. Какую структуру образуют эти составные части клеточной стенки грамположительных бактерий, мы пока еще не знаем. С помощью электронных фотографий тонких срезов (слоистости) в стенках грамположительных бактерий не обнаружено. Вероятно, все эти вещества очень плотно связаны между собой.
Стенки грамотрицательных бактерий более сложные по химическому составу, в них содержится значительное количество липидов (жиров), связанных с белками и сахарами в сложные комплексы — липопротеиды и липополисахариды. Муреина в клеточных стенках грамотрицательных бактерий в целом меньше, чем у грамположительных бактерий. Структура стенки грамотрицательных бактерий также более сложная. С помощью электронного микроскопа было установлено, что стенки этих бактерий многослойные (рис. 6).
Внутренний слой состоит из муреина. Над ним находится более широкий слой из неплотно упакованных молекул белка. Этот слой в свою очередь покрыт слоем липополисахарида. Самый верхний слой состоит из липопротеидов.
Клеточная стенка проницаема: через нее питательные вещества свободно проходят в клетку, а продукты обмена выходят в окружающую среду. Крупные молекулы с большим молекулярным весом не проходят через оболочку.
Капсула. Клеточная стенка многих бактерий сверху окружена слоем слизистого материала — капсулой (рис. 7). Толщина капсулы может во много раз превосходить диаметр самой клетки, а иногда она настолько тонкая, что ее можно увидеть лишь через электронный микроскоп, — микрокапсула.
Капсула не является обязательной частью клетки, она образуется в зависимости от условий, в которые попадают бактерии. Она служит защитным покровом клетки и участвует в водном обмене, предохраняя клетку от высыхания.
По химическому составу капсулы чаще всего представляют собой полисахариды. Иногда они состоят изгликопротеидов (сложные комплексы сахаров и белков) и полипептидов (род Bacillus), в редких случаях — из клетчатки (род Acetobacter).
Слизистые вещества, выделяемые в субстрат некоторыми бактериями, обусловливают, например, слизисто-тягучую консистенцию испорченного молока и пива.
Цитоплазма. Все содержимое клетки, за исключением ядра и клеточной стенки, называется цитоплазмой. В жидкой, бесструктурной фазе цитоплазмы (матриксе) находятся рибосомы, мембранные системы, митохондрии, пластиды и другие структуры, а также запасные питательные вещества. Цитоплазма обладает чрезвычайно сложной, тонкой структурой (слоистая, гранулярная). С помощью электронного микроскопа раскрыты многие интересные детали строения клетки.
Внешний липопротвидный слой протопласта бактерий, обладающий особыми физическими и химическими свойствами, называется цитоплазматической мембраной (рис. 2, 15).
Внутри цитоплазмы находятся все жизненно важные структуры и органеллы.
Цитоплазматическая мембрана выполняет очень важную роль — регулирует поступление веществ в клетку и выделение наружу продуктов обмена.
Через мембрану питательные вещества могут поступать в клетку в результате активного биохимического процесса с участием ферментов. Кроме того, в мембране происходит синтез некоторых составных частей клетки, в основном компонентов клеточной стенки и капсулы. Наконец, в цитоплазматической мембране находятся важнейшие ферменты (биологические катализаторы). Упорядоченное расположение ферментов на мембранах позволяет регулировать их активность и предотвращать разрушение одних ферментов другими. С мембраной связаны рибосомы — структурные частицы, на которых синтезируется белок. Мембрана состоит из липопротеидов. Она достаточно прочна и может обеспечить временное существование клетки без оболочки. Цитоплазматическая мембрана составляет до 20% сухой массы клетки.
Между плазматической мембраной и клеточной стенкой имеется связь в виде десмозов — мостиков. Цитоплазматическая мембрана часто дает инвагинации — впячивания внутрь клетки. Эти впячивания образуют в цитоплазме особые мембранные структуры, названныемезосомами. Некоторые виды мезосом представляют собой тельца, отделенные от цитоплазмы собственной мембраной. Внутри таких мембранных мешочков упакованы многочисленные пузырьки и канальцы (рис. 2). Эти структуры выполняют у бактерий самые различные функции. Одни из этих структур — аналоги митохондрий. Другие выполняют функции зндоплазматической сети или аппарата Гольджи. Путем инвагинации цитоплазматической мембраны образуется также фотосинтезирующий аппарат бактерий. После впячивания цитоплазмы мембрана продолжает расти и образует стопки (табл. 30), которые по аналогии с гранулами хлоропластов растений называют стопками тилакоидов. В этих мембранах, часто заполняющих собой большую часть цитоплазмы бактериальной клетки, локализуются пигменты (бактериохлорофилл, каротиноиды) и ферменты (цитохромы), осуществляющие процесс фотосинтеза.
В цитоплазме бактерий содержатся рибосомы— белок-синтезирующие частицы диаметром 200А. В клетке их насчитывается больше тысячи. Состоят рибосомы из РНК и белка. У бактерий многие рибосомы расположены в цитоплазме свободно, некоторые из них могут быть связаны с мембранами.
Рибосомы являются центрами синтеза белка в клетке. При этом они часто соединяются между собой, образуя агрегаты, называемые полирибосомами или полисомами.
В цитоплазме клеток бактерий часто содержатся гранулы различной формы и размеров. Однако их присутствие нельзя рассматривать как какой-то постоянный признак микроорганизма, обычно оно в значительной степени связано с физическими и химическими условиями среды. Многие цитоплазматические включения состоят из соединений, которые служат источником энергии и углерода. Эти запасные вещества образуются, когда организм снабжается достаточным количеством питательных веществ, и, наоборот, используются, когда организм попадает в условия, менее благоприятные в отношении питания.
У многих бактерий гранулы состоят из крахмала или других полисахаридов — гликогена и гранулезы. У некоторых бактерий при выращивании на богатой сахарами среде внутри клетки встречаются капельки жира. Другим широко распространенным типом гранулярных включений является волютин (метахроматиновые гранулы). Эти гранулы состоят из полиметафосфата (запасное вещество, включающее остатки фосфорной кислоты). Полиметафосфат служит источником фосфатных групп и энергии для организма. Бактерии чаще накапливают волютин в необычных условиях питания, например на среде, не содержащей серы. В цитоплазме некоторых серных бактерий находятся капельки серы.
Помимо различных структурных компонентов, цитоплазма состоит из жидкой части — растворимой фракции. В ней содержатся белки, различные ферменты, т-РНК, некоторые пигменты и низкомолекулярные соединения — сахара, аминокислоты.
В результате наличияв цитоплазме низкомолекулярных соединений возникает разность в осмотическом давлении клеточного содержимого и наружной среды, причем у разных микроорганизмов это давление может быть различным. Наибольшее осмотическое давление отмечено у грамположительных бактерий — 30 атм, у грамотрицательных бактерий оно гораздо ниже — 4—8 атм.
Ядерный аппарат. В центральной части клетки локализовано ядерное вещество — дезоксирибонуклеиновая кислот а (ДНК).
У бактерий нет такого ядра, как у высших организмов (эукариотов), а есть его аналог — «ядерный эквивалент» — нуклеоид (см. рис. 2, 8), который является эволюционно более примитивной формой организации ядерного вещества. Микроорганизмы, не имеющие настоящего ядра, а обладающие его аналогом, относятся к прокариотам. Все бактерии — прокариоты. В клетках большинства бактерий основное количество ДНК сконцентрировано в одном или нескольких местах. В клетках эукариотов ДНК находится в определенной структуре — ядре. Ядро окружено оболочкой— мембраной.
У бактерий ДНК упакована менее плотно, в отличие от истинных ядер; нуклеоид не обладает мембраной, ядрышком и набором хромосом. Бактериальная ДНК не связана с основными белками — гистонами — ив нуклеоиде расположена в виде пучка фибрилл.
Жгутики. На поверхности некоторых бактерий имеются придаточные структуры; наиболее широко распространенными из них являются жгутики — органы движения бактерий.
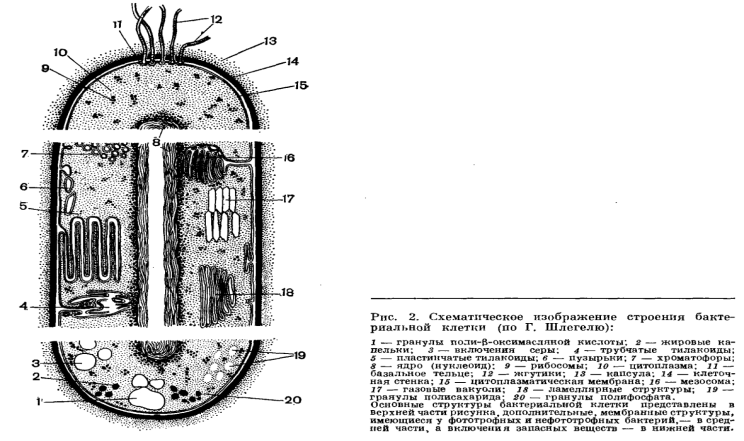
Жгутик закрепляется под цитоплазматической мембраной с помощью двух пар дисков. У бактерий может быть один, два или много жгутиков. Расположение их различно: на одном конце клетки, на двух, по всей поверхности и т. д. (рис. 9). Жгутики бактерий имеют диаметр 0,01—0,03 мкм, длина их может во много раз превосходить длину клетки. Бактериальные жгутики Состоят из белка — флагеллина — и представляют собой скрученные винтообразные нити.
 23. Ферме?нты или энзи?мы (от лат. fermentum, греч. ζ?μη,?νζυμον — закваска) — обычно белковые молекулы или молекулы РНК(рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу). Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают).Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
23. Ферме?нты или энзи?мы (от лат. fermentum, греч. ζ?μη,?νζυμον — закваска) — обычно белковые молекулы или молекулы РНК(рибозимы) или их комплексы, ускоряющие (катализирующие) химические реакции в живых системах. Реагенты в реакции, катализируемой ферментами, называются субстратами, а получающиеся вещества — продуктами. Ферменты специфичны к субстратам (АТФаза катализирует расщепление только АТФ, а киназа фосфорилазы фосфорилирует только фосфорилазу). Ферментативная активность может регулироваться активаторами и ингибиторами (активаторы — повышают, ингибиторы — понижают).Белковые ферменты синтезируются на рибосомах, а РНК — в ядре.
Функции ферментов
Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется более 4000 разных биохимических реакций[2]. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность — константа связывания некоторых субстратов с белком может достигать 10−10 моль/л и менее. Каждая молекула фермента способна выполнять от нескольких тысяч до нескольких миллионов «операций» в секунду. Например, одна молекула фермента ренина, содержащегося в слизистой оболочке желудка теленка, створаживает около 106 молекул казеиногена молока за 10 мин при температуре 37 °C. При этом эффективность ферментов значительно выше эффективности небелковых катализаторов — ферменты ускоряют реакцию в миллионы и миллиарды раз, небелковые катализаторы — в сотни и тысячи раз. См. также Каталитически совершенный фермент
ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ
Ферменты, являясь белками, обладают рядом характерных для этого класса органических соединений свойств, отличающихся от свойств неорганических катализаторов.
Термолабильность ферментов. Скорость химических реакций зависит от температуры, поэтому катализируемые ферментамиреакции также чувствительны к изменениям температуры. Установлено, что скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Так, при температуре, не превышающей 45–50°С, скорость реакции увеличивается согласно теории химической кинетики. При температуревыше 50°С на скорость реакции большое влияние начинает оказывать тепловая денатурация белка-фермента, приводящая к полному прекращению ферментативного процесса (рис. 4.16).
Таким образом, термолабильность, или чувствительность к повышению температуры, является одним из характерных свойствферментов, резко отличающих их от неорганических катализаторов. В присутствии последних скорость реакции возрастает экспоненциально при повышении температуры (см. кривую «а» на рис. 4.16). При температуре 100°С почти все ферменты утрачивают свою активность (исключение составляет, очевидно, только один фермент мышечной ткани – миокиназа, которая выдерживает нагревание до 100°С). Оптимальной для действия большинства ферментов теплокровных животных является температура 40°С; в этих условиях скорость реакции оказывается максимальной вследствие увеличения кинетической энергии реагирующих молекул. При низкихтемпературах (0°С и ниже) ферменты, как правило, не разрушаются, хотя активность их падает почти до нуля. Во всех случаях имеет значение время воздействия соответствующей температуры. В настоящее время для пепсина, трипсина и ряда других ферментовдоказано существование прямой зависимости
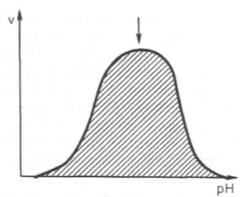
Рис. 4.17. Зависимость скорости катализируемой ферментом реакции от рН (стрелка указывает оптимум рН).
между скоростью инактивации фермента и степенью денатурации белка. Следует отметить, что на термолабильность ферментовопределенное влияние оказывает концентрация субстрата, рН среды и другие факторы. Зависимость активности ферментов от рН среды. Ферменты обычно наиболее активны в пределах узкой зоны концентрации водородных ионов, соответствующей для животныхтканей в основном выработанным в процессе эволюции физиологическим значениям рН среды 6,0–8,0. При графическом изображении на кривой колоколообразной формы имеется определенная точка, в которой фермент проявляет максимальную активность; эту точку называют оптимумом рН среды для действия данного фермента (рис. 4.17). При определении зависимости активности фермента отконцентрации водородных ионов реакцию проводят при разных значениях рН среды, обычно при оптимальной температуре и наличии достаточно высоких (насыщающих) концентраций субстрата. В табл. 4.3 приводятся оптимальные значения рН среды для рядаферментов.
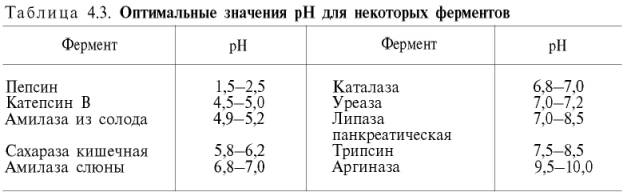
Из данных табл. 4.3 видно, что рН-оптимум действия ферментов лежит в пределах физиологических значений. Исключение составляютпепсин, рН-оптимум которого 2,0 (при рН 6,0 он не активен и не стабилен). Объясняется это, во-первых, структурной организациеймолекулы фермента и, во-вторых, тем, что пепсин является компонентом желудочного сока, содержащего свободную соляную кислоту, которая создает оптимальную кислую среду для действия этого фермента. С другой стороны, рН-оптимум аргиназы лежит в сильнощелочной зоне (около 10,0); такой среды нет в клетках печени, следовательно, in vivo аргиназа функционирует, по-видимому, не в своей оптимальной зоне рН среды.
Согласно современным представлениям, влияние изменений рН среды на молекулу фермента заключается в воздействии на состояние и степень ионизации кислотных и основных групп (в частности, СООН-группы дикар-боновых аминокислот, SH-группы цистеина, имидазольного азота гисти-дина, NH2-группы лизина и др.). При резких сдвигах от оптимума рН среды ферменты могут подвергаться конформационным изменениям, приводящим к потере активности вследствие денатурации или изменения заряда молекулы фермента. При разных значениях рН среды активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного фермент-субстратного комплекса. Имеет значение, кроме того, состояние ионизации субстратов и кофакторов.
Специфичность ферментов. Ферменты обладают высокой специфичностью действия. Это свойство часто существенно отличает их от неорганических катализаторов. Так, мелкоизмельченные платина и палладий могут катализировать восстановление (с участием молекулярного водорода) десятков тысяч химических соединений различной структуры. Высокая специфичность ферментовобусловлена, как было отмечено, конфор-мационной и электростатической комплементарностью между молекулами субстрата ифермента и уникальной структурной организацией активного центра, обеспечивающими «узнавание», высокое сродство и избирательность протекания одной какой-либо реакции из тысячи других химических реакций, осуществляющихся одновременно в живых клетках.
В зависимости от механизма действия различают ферменты с относительной (или групповой) и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Например,пепсин в одинаковой степени расщепляет белки животного и растительного происхождения, несмотря на то что эти белки существенно отличаются друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однакопепсин не расщепляет ни углеводы, ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина является пептидная —СО—NH-связь. Для действия липазы, катализирующей гидролиз жиров на глицерин и жирные кислоты, подобным местом является сложноэфирная связь. Аналогичной групповой специфичностью обладают трипсин, химотрипсин, пептидазы, ферменты, гидроли-зующие α-гликозидные связи (но не β-гликозидные связи, имеющиеся в целлюлозе) в полисахаридах, и др. Обычно этиферменты участвуют в процессе пищеварения, и их групповая специфичность, вероятнее всего, имеет определенный биологический смысл. Относительной специфичностью наделены также некоторые внутриклеточные ферменты, например гексокиназа, катализирующая в присутствии АТФ фосфорилиро-вание почти всех гексоз, хотя одновременно в клетках имеются и специфические для каждой гексозы ферменты, выполняющие такое же фос-форилирование (см. главу 10).
Абсолютной специфичностью действия называют способность фермента катализировать превращение только единственногосубстрата. Любые изменения (модификации) в структуре субстрата делают его недоступным для действия фермента. Примерами такихферментов могут служить аргиназа, расщепляющая в естественных условиях (в организме) аргинин, уреаза, катализирующая распадмочевины, и др.
Имеются экспериментальные доказательства существования так называемой стереохимической специфичности, обусловленной существованием оптически изомерных L- и D-форм или геометрических (цис-и транс-) изомеров химических веществ. Так, известны оксидазы L- и D-аминокислот, хотя в природных белках обнаружены только L-ами-нокислоты. Каждый из видов оксидаз действует только на свой специфический стереоизомер.
Наглядным примером стереохимической специфичности является бактериальная аспартатдекарбоксилаза, катализирующая отщепление СО2 только от L-аспарагиновой кислоты с превращением ее в L-аланин. Сте-реоспецифичность проявляют ферменты, катализирующие и синтетические реакции. Так, из аммиака и α-кетоглутарата во всех живых организмах синтезируется L-изомерглутаминовой кислоты, входящей в состав природных белков. Если какое-либо соединение существует в форме цис-и транс-изомеров с различным расположением групп атомов вокруг двойной связи, то, как правило, только один из этих геометрических изомеров может служить в качестве субстрата для действия фермента. Например, фумараза катализирует превращение только фумаровой кислоты(трансизомер), но не действует на малеиновую кислоту (цис-изомер):
Таким образом, благодаря высокой специфичности действия ферменты обеспечивают протекание с большой скоростью лишь определенных химических реакций из огромного разнообразия возможных превращений в микропространстве клеток и целостном организме, регулируя тем самым интенсивность обмена веществ.
Роль ферментов в обмене веществ.
| Обмен веществ и энергии является непременным условием жизни, основой всех жизненных процессов, происходящих в организме. С прекращением обмена веществ прекращается жизнь и организм умирает.Человеческий организм представляет собой единое целое, в котором функции различных органов и тканей тесно связаны между собой. При изучении обмена веществ следует исходить из этого представления о единстве организма и взаимосвязи его частей. Источником энергии в организме человека является пища. Пищевые вещества, подвергшиеся расщеплению в процессе пищеварения, всасываются через слизистую оболочку кишок. Продукты расщепления жиров попадают в лимфу, а затем по лимфатическим путям — в кровь. Глюкоза и другие моносахариды, а также аминокислоты попадают прямо в ток крови. Моносахариды в печени и мышцах синтезируются в животный крахмал (гликоген). В дальнейшем из крови и лимфы клетки и ткани организма получают все необходимые им вещества. Ферментами называются специфические белки, которые содержатся во всех тканях и клетках живого организма. Ферменты играют роль биологических катализаторов, т. е. веществ, обладающих способностью резко ускорять те или иные химические реакции, и обусловливают необходимые для жизнедеятельности организма превращения веществ. Известно, что белки, жиры, углеводы, содержащиеся во многих продуктах питания, довольно устойчивы к кислороду воздуха. Такие продукты, как сахар, крупа, мука, крахмал и др., могут храниться долго, не подвергаясь изменениям. Для того чтобы вне организма добиться расщепления белков, жиров и углеводов на простейшие соединения, их приходится подвергать длительному кипячению с концентрированными растворами минеральных кислот или щелочей. Тогда белки распадаются на аминокислоты, жиры — на глицерин и высшие жирные кислоты, полисахариды — на простые сахара. Эти же процессы расщепления происходят в пищеварительном тракте человека при температуре тела 37° и при умеренно кислой реакции в желудке и слабо щелочной реакции в кишечнике. Свойство пищеварительных соков расщеплять основные вещества, содержащиеся в пище, связано с наличием в них различных ферментов (пепсина, трипсина, липазы, амилазы и др.), которые и обеспечивают достаточно быстрый ход реакции. Попав в человеческий организм, белки, жиры, углеводы подвергаются различным изменениям, а затем после всасывания и усвоения окисляются с образованием воды и углекислого газа, т. е. медленно «сгорают» в организме. Таким образом, не только процесс пищеварения, но и усвоение питательных веществ клетками тела, поглощение кислорода тканями и образование углекислоты, освобождение энергии и многие другие химические процессы в клетках и тканях протекают при участии ферментов. |
 2015-05-26
2015-05-26 18689
18689








