15.1. В 1 л раствора содержится 18,4 г глицерина С3Н5(ОН)3 при 17оС. Чему равно осмотическое давление раствора?
15.2. Осмотическое давление раствора глюкозы при 0оС 454 кПа. Какова молярность раствора?
15.3. Найти осмотическое давление 5%-ного раствора ацетона (ρ = 0,9 г/мл) при 7оС.
15.4. В 40 мл раствора содержится 0,72 г неэлектролита. Раствор изотоничен 0,1 М раствору мочевины СО(NН2)2. Найти молярную массу неэлектролита.
15.5. Антифризы – жидкости с пониженной температурой замерзания, применяемые в системе охлаждения моторов автомобилей и тракторов. Вычислите массу этиленгликоля С2Н4(ОН)2, которую необходимо добавить к 1 кг воды для приготовления антифриза с температурой замерзания -15оС.
15.6. Температура кипения этилового спирта 78,3оС. Раствор, содержащий 6,57 г йода в 100 г спирта, закипает 78,6оС. Какова молекулярная формула йода?
15.7. Каково давление пара раствора, содержащего 0,2 моль сахара в 450 г воды?
15.8. Определите молярную массу анилина, зная, что при 30оС давление пара раствора, содержащего 3,09 г анилина в 370 г эфира (С2Н5)2О, равно 643,6 мм рт. ст., а давление пара чистого эфира при той же температуре равно 647,9 мм рт. ст.
15.9. При растворении 0,94 г фенола в 50 г этилового спирта температура кипения последнего повысилась на 0,232оС. Найти молярную массу фенола.
15.10. Температура затвердевания чистого бензола 5,5 оС, а раствора
1,632 г трихлоруксусной кислоты СС1СООН в 100 г бензола 5,15 оС. Подвергаются ли молекулы кислоты в бензольном растворе ассоциации или диссоциации и в какой степени?
15.11. К 10 мл бензола (ρ = 0,879 г/мл) добавили 0,5548 г нафталина. Температура затвердевания полученного раствора 2,981оС. Определите молярную массу нафталина в бензоле, если температура затвердевания чистого бензола 5,5оС, а его теплота плавления Δh =127,4 Дж/г.
15.12. В 10,6 г раствора салициловой кислоты в этаноле содержится
0,401 г салициловой кислоты. Повышение температуры кипения раствора равно 0,320оС, теплота парообразования этанола Δ1 = 906 Дж/г. Определите молярную массу салициловой кислоты, растворенной в спирте.
15.13. Сколько воды и раствора неэлектролита (по объему) с осмотическим давлением 20 атм надо взять, чтобы приготовить 5 л раствора с давлением 6 атм.?
15.14 Температура кипения раствора 12,8 г серы в 250 г бензола на 0,514о выше, чем у чистого растворителя. Выведите молекулярную формулу серы.
15.15. Из 342 г сахара и воды приготовлено 22,4 л раствора. Найдите осмотическое давление раствора двумя способами.
15.16.* Камфара (температура плавления 1800С)одно время широко использовалась дляоценки молекулярной массы органических соединений, так как у неё довольно большая криоскопическая константа: К = 37,7. При тщательном измельчении 0,125 г серы с 3,63 г камфары температура плавления последней уменьшилась на 5,08 0С. Определите молекулярную массу серы и формулу молекулы серы.
15.17.* Адреналин – гормон, регулирующий выделение в кровь дополнительных молекул глюкозы в критических ситуациях, имеет следующий состав (масс. %): С – 59,0; О – 26,2; Н – 7,1; N -7,6. Температура кипения раствора, содержащего 0,64 г адреналина в 36,0 г четыреххлористого углерода на 0,64 0С больше температуры кипения чистого CCl4. Найдите молярную массу адреналина и его химическую формулу.
15.18.* Осмотическое давление раствора, содержащего 1 г сахара в 100 мл воды составляет 0,655 атм при 00С. Докажите, что константа R в уравнении Вант – Гоффа имеет то же численное значение, что и для газов.
15.19. Среднее осмотическое давление крови при 25оС равно7,7 атм. Какой должна быть молярная концентрация глюкозы, чтобы ее раствор был изотоничен крови?
15.20. Осмотическое давление раствора 0,200 г гемоглобина в 20,0 мл воды при 25оС 2,88 мм рт. ст. Найдите молекулярную массу гемоглобина.
15.21. Белок альбумин имеет М = 69 000 г/моль. Рассчитайте осмотическое давление раствора, содержащего 2 г альбумина в 100 мл его водного раствора при 25оС.
Опорный конспект №16. «Коллигативные свойства водных растворов электролитов»
Электролиты – это вещества, полностью или частично распадающиеся на ионы в растворе или расплаве.
Распад на ионы под действием полярных молекул растворителя называется электролитической диссоциацией.
Сила электролита определяется степенью его диссоциации:
α = Nрасп/Nнач., 16.1)
где Nнач – число молекул в исходном растворе, Nрасп. – число молекул, распавшихся на ионы. Различают слабые (α < 5%) и сильные электролиты.
Процесс диссоциации слабых электролитов обратим и к нему применим закон действия масс:
КА ↔ К+ + А-
Состояние равновесия характеризуется константой равновесия, которая не зависит от концентрации электролита, а зависит от его природы и температуры:
Кдиссоц.= [K+][A-]/ [KA] (16.2)
Степень диссоциации и константа диссоциации связаны между собой законом разведения Оствальда:
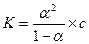 (16.3),
(16.3),
где с – молярная концентрация, моль/л. Если с <<1 (очень слабые электролиты), то степенью диссоциации в знаменателе можно пренебречь, тогда:
Кдиссоц= α2 с (16.4)
Сильные электролиты диссоциируют в водных растворах практически нацело.
Степень отклонения экспериментальных данных от рассчитанных теоретически учитывает «кажущаяся степень диссоциации»:
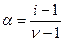 (16.5),
(16.5),
где 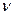 - число ионов, на которые диссоциирует электролит, i – изотонический коэффициент Вант – Гоффа. Он показывает, во сколько раз экспериментально найденные значения коллигативных свойств: осмотического давления, понижения давления паров над раствором, снижения температуры замерзания и повышения температуры кипения раствора электролита превышают ту же величину для раствора неэлектролита той же начальной концентрации:
- число ионов, на которые диссоциирует электролит, i – изотонический коэффициент Вант – Гоффа. Он показывает, во сколько раз экспериментально найденные значения коллигативных свойств: осмотического давления, понижения давления паров над раствором, снижения температуры замерзания и повышения температуры кипения раствора электролита превышают ту же величину для раствора неэлектролита той же начальной концентрации:
i = πэксперим./πвычисл. (16.6)
Сопоставляя значения ν и i, можно оценить меру отклонения раствора электролита от идеального: 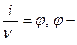 осмотический коэффициент.
осмотический коэффициент.
 2015-05-26
2015-05-26 1682
1682
