Рассчитанное по закону Вант - Гоффа осмотическое давление может не совпадать с полученным опытным путем в случаях, когда реальное число химических частиц в растворе будет больше или меньше расчетного. Это может произойти в том случае, если в растворе будут происходить процессы ассоциации или диссоциации молекул растворенного вещества. Оценить глубину отклонения можно с помощью изотонического коэффициента Вант -Гоффа: i = πоп./πтеор. При значениях коэффициента больше единицы в растворе идет процесс диссоциации, при значениях коэффициента меньше единицы, наоборот, происходит ассоциация.
Пример 1. Определите осмотическое давление децимолярного раствора неэлектролита при ОоС двумя способами.
Решение: Способ 1. 1л раствора содержит 0,1 моль вещества
22,4 л - х = 2,24 моль
При содержании 1 моль вещества в 22,4 л раствора π = 101,325 кПа, тогда при содержании в растворе 2,24 моль вещества π = 2,24×101,325/1 = 227 кПа
Способ 2. Воспользуемся уравнением (15.2):
π = 0,1 × 8,314 × 273 = 227 кПа
Пример 2. Рассчитайте осмотическое давление одномолярного раствора сахарозы в воде, зная, что при 30оС давление паров над раствором р = 31,207 мм рт. ст., давление паров над водой ро= 31,824 мм рт. ст., а плотность воды ρ30оС = 0,99564 г/см3.
Решение: Молярный объем воды при температуре опыта:
V¯= 18,02/0,99564 = 18,10 см3/моль или 0,01810 л/ моль
При выражении объема в литрах, а давления в атмосферах, R = 0,08205. Bоспользовавшись уравнением (15.11), получим:
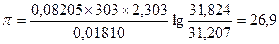 атм
атм
Приближенный расчет по формуле (15.1) дает:
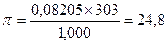 атм
атм
Пример 3. Упругость пара раствора, содержащего 11,94 г гликокола (С2Н5NН2) в 100 г воды, равна 740,9 мм рт.ст. при 100оС. Какова молярная масса растворенного вещества?
Решение: Воспользуемся формулой (15.6):
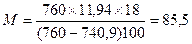 г/моль
г/моль
Пример 4. Раствор, содержащий 8 г нафталина С10Н8 в 100 г диэтилового эфира, кипит при 36,33оС, чистый эфир кипит при 35оС. Найти эбулиоскопическую константу эфира.
Решение: ΔТ = 36,33 – 35 = 1,33 о
Кэб. = 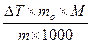 , Кэб.=
, Кэб.= 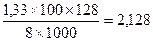
Пример 5. Осмотическое давление разбавленных растворов является аддитивным свойством, поэтому для решения ряда задач к нему применимо «правило креста» или квадрат Пирсона:

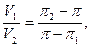 где
где 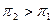
В каких объемных соотношениях надо смешивать растворы неэлектролитов, имеющих осмотические давления 12 и 3 атм, чтобы получить раствор с давлением 4, 8 атм?
Решение: В соответствии с правилом креста: 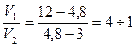

 2015-05-26
2015-05-26 1017
1017








