Гидролизом солей называют реакцию обмена между водой и растворенными в ней солями. В результате протекания процесса гидролиза соли в растворе появляется избыток ионов Н+ или ОН-, сообщающий раствору кислотные или щелочные свойства. Гидролиз протекает обратимо и сопровождается изменением рН раствора.
1. Гидролиз по катиону. Ему подвергаются соли,образованные катионом слабого основания и анионом сильной кислоты. В результате образуется слабодиссоциирующий электролит и сильная кислота, среда кислая, рН < 7.
Пример 24. Напишите ионное и молекулярное уравнение гидролиза NH4Cl, укажите реакцию среды и рН раствора.
Решение. 1. Уравнение диссоциации:
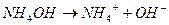
2. Ион NH4+ взаимодействует с водой с образованием слабодиссоциирующего основания, ионное уравнение гидролиза: 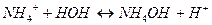 , рН>7, среда щелочная
, рН>7, среда щелочная
3.Молекулярное уравнение гидролиза:
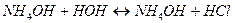
2. Гидролизу по аниону подвергаются соли, образованные катионом сильного основания и анионом слабой кислоты. При гидролизе образуется слабодиссоциирующий электролит и сильное основание, среда щелочная, рН > 7.
Пример 25. Напишите ионное и молекулярное уравнение гидролиза KF, укажите реакцию среды и рН раствора.
Решение. 1. Уравнение диссоциации:
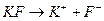
2.Ион F- взаимодействует с водой с образованием слабодиссоциирующей кислоты и сильного основания, ионное уравнение гидролиза:
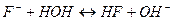 , рН > 7, среда щелочная.
, рН > 7, среда щелочная.
3. Молекулярное уравнение гидролиза:
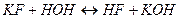
3. Гидролизу по катиону и аниону подвержены соли, образованные слабым основанием и слабой кислотой. В этом случае образуются слабодиссоциирующие кислота и основание. Реакция среды зависит от соотношения констант диссоциации образующихся кислоты и основания.
Пример 26. Напишите ионное и молекулярное уравнение гидролиза NH4CN, укажите среду и рН раствора.
Решение. 1.Уравнение диссоциации:

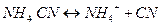
2. Ионы NH4+ и CN- взаимодействуют с водой с образованием слабодиссоциирующих основания и кислоты. Образующиеся при гидролизе ионы Н+ и ОН- связываются в молекуле Н2О, что усиливает гидролиз по катиону и аниону:
NH4+ + CN- +2H2O↔ NH4OH + HCN + Н2О
3. Молекулярное уравнение гидролиза:
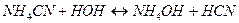
4. Гидролиз солей, образованных сильной кислотой и сильным основанием, не происходит.
5.Ступенчатый гидролиз. Если соль образована слабым
многозарядным катионом (или анионом), то она подвергается ступенчатому гидролизу.
Пример 27. Напишите ионное и молекулярное уравнение гидролиза K2S, укажите среду и рН раствора.
Решение. 1. Уравнение диссоциации:
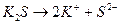
2. Ионное и молекулярное уравнения гидролиза по 1-ой ступени:
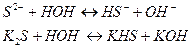 рН > 7, среда щелочная
рН > 7, среда щелочная
3. Ионное и молекулярное уравнения гидролиза по 2-й ступени:
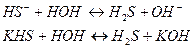 рН > 7, среда щелочная.
рН > 7, среда щелочная.
Следует заметить, что соли, образованные слабым многозарядным катионом или слабым многозарядным анионом, гидролизуются преимущественно по 1-ой ступени.
Если кислота и основание, образующие соль, не только являются слабыми электролитами, но и малорастворимы, неустойчивы и разлагаются с образованием газообразных продуктов, гидролиз таких солей протекает практически необратимо:
Al2S3 + 6H2O→ Al(OH)3↓ + 3H2S↑
 2015-05-26
2015-05-26 1580
1580