К группе повышенного риска относят больных, которые в связи с далеко зашедшим поражением печени нуждаются в интенсивной терапии и особенно в искусственной вентиляции лёгких.
Особенно хорошие результаты трансплантации печени отмечаются у детей, однако выполнение её у детей до 2 лет технически более сложно. Пожилой возраст как таковой не является абсолютным противопоказанием к операции; большее значение при рассмотрении показаний к трансплантации печени имеет не паспортный, а биологический возраст; необходимо учитывать общее состояние больного. Тем не менее, обычно трансплантацию печени производят у больных не старше 60 лет.
По данным немногочисленных исследований, пересадка печени от женщины-донора мужчине-реципиенту сопровождается менее благоприятными результатами, однако для подтверждения этого факта необходимо большее количество наблюдений.
Операция связана с большим риском, если масса тела больного превышает 100 кг.
Таблица 35-4. Абсолютные и относительные противопоказания к трансплантации печени
|
|
|
Абсолютные
Психологическая, физическая и социальная несостоятельность больного Активные инфекции Метастазы злокачественной опухоли Холангиокарцинома СПИД Декомпенсированное сердечно-лёгочное заболевание
Относительные
Возраст старше 60 лет или младше 2 лет Выполненное ранее портокавальное шунтирование Выполненное ранее оперативное вмешательство на печени и жёлчных путях Тромбоз воротной вены Повторная трансплантация Полиорганная трансплантация Ожирение
Уровень креатинина более 0,176 ммоль/л (2 мг%) Трансплантация от CMV-положительного донора CMV-отрицательному реципиенту Далеко зашедшее поражение печени
Повторная трансплантация или полиорганная трансплантация связаны с большим риском.
Претранс плантационный уровень сывороточного креатинина, превышающий 2 мг%, является наиболее точным прогностическим фактором риска посттрансплантационной летальности [31].
Трансплантация печени от CMV-положительного донора CMV-отрицательному реципиенту связана с большим риском.
Тромбоз воротной вены затрудняет выполнение трансплантации и снижает выживаемость. Тем не менее операция обычно возможна [133]. У таких больных анастомоз формируют между воротной веной донора и местом слияния верхней брыжеечной и селезёночной вен реципиента либо используют донорский венозный трансплантат.
Предшествующее трансплантации портокавальное шунтирование затрудняет выполнение операции, поэтому целесообразно прибегать к дистальному спленоренальному шунтированию. Оптимальным вмешательством по поводу кровотечения из варикозно-расширенных вен является трансъюгулярное внутрипеченочное портосистемное шунтирование с помощью стентов, которое не создаёт технических трудностей для последующей трансплантации [2].
|
|
|
Ретрансплантация сопряжена с большими техническими трудностями. Проводившиеся ранее хирургические вмешательства на верхнем этаже брюшной полости могут сделать трансплантацию печени технически невыполнимой.
Общая подготовка больного
Больного готовят к операции по стандартной методике. Следует обсудить с больным и его родственниками все детали предстоящей операции и получить их согласие на неё.
Проводят стандартные клинические, биохимические и серологические исследования, принятые у больных с заболеваниями печени.
Определяют группу крови, антигены HLA и DR, анти-CMV- и анти-НСV-антитела, а также маркёры гепатита В.
У больных со злокачественными опухолями используют все возможные методы для исключения метастазов.
Должна быть визуализирована печёночная артерия для обнаружения любых анатомических отклонений, включая аномальное отхождение печёночной артерии и предуоденальное расположение воротной вены. Также следует визуализировать воротную и нижнюю полую вены. Проводят и селективную ангиографию правой почечной артерии, так как не распознанное вовремя высокое расположение правой почки может привести к неизбежной правосторонней нефрэктомии. Жёлчные протоки перед операцией исследуют путём холангиографии, выполняемой обычно эндоскопически. Проводят стандартные ультразвуковое исследование (УЗИ) и компьютерную томографию (КТ). Тщательная оценка состояния сердца и лёгких должна включать измерение давления в лёгочных венах.
Предоперационная подготовка занимает приблизительно 10 дней. В неё входят подтверждение диагноза, консультация психиатра. Больной может ожидать многие месяцы подходящей донорской печени, и в этот период необходима интенсивная психосоциальная поддержка.
Проводят вакцинацию против HBV, пневмококков и вируса гриппа.
Подбор донора и операция
Процесс отбора доноров стандартизован [106]. Однако критерии «хорошей» или «плохой» печени в разных клиниках различные. Растущая потребность в проведении трансплантации печени привела к использованию донорских органов, которые раньше могли быть признаны непригодными. При этом существенного учащения случаев неудач, связанных с плохой функцией трансплантата, не произошло.
Информированное согласие даётся родственниками донора. Возраст донора может быть от 2 мес до 55 лет. Донором печени является человек, получивший черепно-мозговую травму, в результате которой наступила смерть мозга.
Поддерживают адекватную деятельность сердечно-сосудистой системы, для осуществления функции дыхания производят искусственную вентиляцию лёгких. Трансплантация печени и других жизненно важных органов от доноров с сокращающимся сердцем сводит к минимуму ишемию, которая появляется при нормальной температуре тела и в значительной степени влияет на исход трансплантации.
У донора не должно быть других заболеваний, в том числе сахарного диабета и ожирения. Гистологическое исследование должно исключить жировые изменения в печени [134]. У донора не должно быть периодов длительной артериальной гипотензии, гипоксии или остановки сердца.
Трансплантация печени без учёта группы крови по системе АВ0 может закончиться тяжёлой реакцией отторжения. Такую печень можно использовать в случае крайней необходимости в неотложных ситуациях [52].
Более трудным является подбор донора по системе HLA. Доказано, что несовместимость по отдельным антигенам HLA II класса даёт преимущества, особенно в предотвращении развития синдрома исчезновения жёлчных протоков [93].
|
|
|
Донора исследуют на маркёры вирусного гепатита В и С, антитела к CMV и ВИЧ.
Детали операции у донора и реципиента обсуждаются во многих работах [22, 82, 120]. После выделения печени её охлаждают введением через селезёночную вену раствора Рингера и дополнительно через аорту и воротную вену 1000 мл раствора Висконсинского университета [63]. Введённая в дистальный конец нижней полой вены канюля обеспечивает венозный отток. После иссечения охлаждённую печень дополнительно промывают через печёночную артерию и воротную вену 1000 мл раствора Висконсинского университета и хранят в этом растворе в пластиковом пакете на льду в переносном холодильнике. Эта стандартная процедура позволила увеличить время хранения донорской печени до 11—20 ч, сделала операцию у реципиента «полуплановой» и выполнимой в более удобное время. Один и тот же хирург может произвести операции у донора и реципиента. Дальнейшее усовершенствование консервации органов [16] включает использование автоматического устройства для перфузии после доставки печени в центр трансплантации. Жизнеспособность трансплантата можно исследовать с использованием ядерного магнитного резонанса.
При подборе донорской печени необходимо, чтобы она по возможности соответствовала по размерам и форме анатомическим особенностям реципиента. Размеры донорской печени не должны быть больше и по возможности не должны быть меньше таковых у реципиента. Иногда печень маленьких размеров имплантируют крупному реципиенту. Донорская печень увеличивается в объёме со скоростью приблизительно 70 мл в день вплоть до достижения размеров, соответствующих массе тела, возрасту и полу реципиента [144].
Операция у реципиента (рис. 35-5)
Средняя продолжительность операции составляет 7,6 ч (4-15 ч). В среднем переливают 17 (2-220) доз эритроцитной массы. Используемый аппарат, возвращающий эритроциты, позволяет сохранить приблизительно треть объёма крови, изливающейся в брюшную полость. При этом кровь аспирируют и эритроциты после многократного отмывания и ресуспендирования вводят больному.
|
|
|
Выделяют анатомические структуры ворот печени, полую вену выше и ниже печени. Выделенные сосуды пережимают, пересекают, после чего удаляют печень.
Во время имплантации донорской печени приходится прерывать кровоток в системах селезёночной и полой вен. В беспечёночном периоде вено-венозное шунтирование с помощью насоса предотвращает депонирование крови в нижней половине тела и отёк органов брюшной полости. Канюли устанавливают в нижнюю полую (через бедренную вену) и воротную вены, отток крови осуществляется в подключичную вену [122].
Веновенозное шунтирование позволяет уменьшить кровоточивость, увеличить допустимое время операции и облегчить её выполнение.
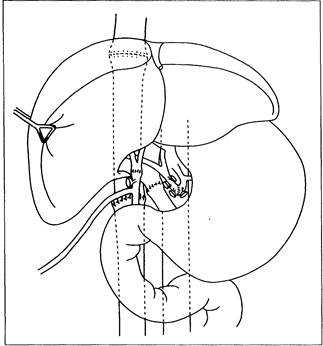
Рис. 35-5. Вид после ортотопической трансплантации печени. Билиарная реконструкция путём наложения холедохохоледохоанастомоза конец в конец.
Наложение всех сосудистых анастомозов завершают до восстановления кровотока в имплантированной печени. Необходимо исключить тромбоз воротной вены. Часто встречаются аномалии печёночной артерии, и для её реконструкции следует использовать донорские сосудистые трансплантаты.
Анастомозы обычно накладывают в следующем порядке: надпечёночный отдел полой вены, под-печёночный отдел полой вены, воротная вена, печёночная артерия, жёлчные протоки. Билиарную реконструкцию обычно выполняют наложением холедохохоледохоанастомоза на Т-образном дренаже. Если у реципиента поражён или отсутствует жёлчный проток, выполняют холедохоеюностомию конец в бок с выключенной по Ру петлёй тощей кишки. Перед ушиванием брюшной полости хирург обычно выжидает примерно 1 ч для выявления и устранения оставшихся источников кровотечения.
Трансплантация частей печени (уменьшенной или разделённой печени)
Из-за трудностей в получении донорских органов малых размеров для трансплантации детям стали использовать часть печени взрослого донора (рис. 35-6) [12]. Этот метод обеспечивает получение двух жизнеспособных трансплантатов из одного донорского органа, хотя обычно используют лишь левую долю или левый латеральный сегмент [38,98]. Соотношение массы тела реципиента и донора должно составлять приблизительно 3:4. В 75% случаев трансплантации печени у детей используют уменьшенный донорский орган взрослого человека.
Результаты не столь удовлетворительны, как при пересадке всего органа (годичная выживаемость составляет соответственно 75 и 85% [18]). Наблюдается большое число осложнений, включая увеличение кровопотери во время операции и неадекватное кровоснабжение трансплантата вследствие гипоплазии воротной вены [8]. Потеря трансплантата и билиарные осложнения у детей наблюдаются чаще, чем у взрослых [14,38].
Трансплантация печени от живого родственного донора
При особых обстоятельствах, обычно у детей, можно использовать в качестве трансплантата левый латеральный сегмент печени от живого родственного донора [38, 60]. Живыми донорами являются кровные родственники больного, которые должны дать добровольное информированное согласие на операцию. Это позволяет получить трансплантат при отсутствии трупного донорского органа. Такую операцию производят у реципиентов с
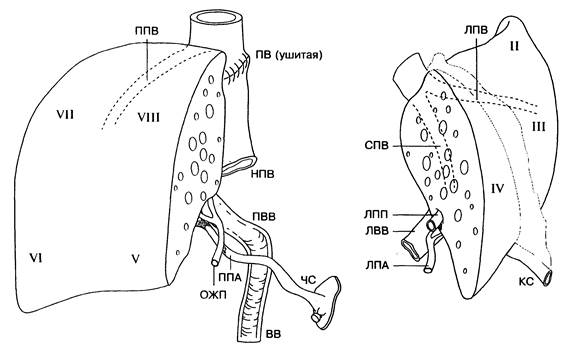
Рис. 35-6. Схематическое изображение двух трансплантатов из одной донорской печени. Как видно, все основные сосуды и жёлчные протоки остаются на правой доле, а левая доля кровоснабжается долевыми ветвями. НПВ — нижняя полая вена;
ВВ — воротная вена; ЧС — чревный ствол; ОЖП — общий жёлчный проток; ПВ — печёночная вена; ПВВ — правая ветвь воротной вены; ППА — правая печёночная артерия; ППВ — правая печёночная вена; ЛПА — левая печёночная артерия;
ЛВВ — левая ветвь воротной вены; ЛПП — левый печёночный проток; ЛПВ — левая печёночная вена; СПВ — срединная печёночная вена; КС — круглая связка. Цифрами обозначены номера сегментов печени [38]. См. также цветную иллюстрацию на с. 794.
терминальной стадией заболевания печени или в странах, где запрещена трансплантация трупных органов. При высоком уровне хирургической техники и анестезиологического пособия, а также интенсивной терапии риск для донора составляет менее 1% [157]. Период госпитализации длится в среднем 11 дней, а кровопотеря составляет только 200—300 мл. Изредка у донора могут развиться осложнения во время операции и после неё, например повреждение жёлчных протоков и селезёнки или абсцедирование.
Эту операцию в основном выполняют у детей [19]. Её применяли при ПБЦ [58], а также при ФПН, когда отсутствовала возможность срочно получить трупную печень. Недостатком операции является также отсутствие времени для предоперационной подготовки донора, в том числе психологической, и заготовки аутологичной крови.
Гетеротопическая трансплантация добавочной печени
При гетеротопической трансплантации здоровую ткань донорской печени пересаживают реципиенту, оставляя его собственную печень [90]. Эта операция может проводиться при ФПН, когда есть надежда на регенерацию собственной печени, а также для лечения некоторых метаболических дефектов.
Обычно используют уменьшенный трансплантат. Левую долю донорской печени удаляют, а сосуды правой доли анастомозируют с воротной веной и аортой реципиента. Донорская печень гипертрофируется, а собственная печень реципиента подвергается атрофии.
После восстановления функции печени больного иммунодепрессивную терапию прекращают. К этому времени дополнительная печень атрофируется и может быть удалена.
Ксенотрансплантация
Трансплантация печени бабуина была осуществлена у HBV- и ВИЧ-положительного больного с терминальной стадией цирроза. Ранние результаты оказались хорошими, однако через 70 дней больной умер от сочетанной бактериальной, вирусной и грибковой инфекций [128]. Подобные операции в дальнейшем не выполнялись, что объясняется нерешенностью ряда вопросов, в том числе связанных с этической стороной проблемы и с защитой прав животных.
Трансплантация печени в педиатрической практике
Средний возраст больных детей составляет приблизительно 3 года; трансплантация была с успехом выполнена и у ребёнка в возрасте до 1 года [9]. Основная трудность заключается в подборе донора для детей, что обусловливает необходимость использования фрагментов трансплантата, полученных в результате уменьшения или разделения взрослой донорской печени.
Рост детей и качество жизни после трансплантации печени не страдают [151].
Маленькие размеры сосудов и жёлчных протоков вызывают трудности технического характера. Перед операцией необходимо исследовать анатомические особенности больного с помощью КТ или, что предпочтительнее, магнитно-резонансной томографии. Тромбоз печёночной артерии наблюдается по крайней мере в 17% случаев [136]. Часто необходимы ретрансплантации. Высока также частота билиарных осложнений.
У детей в возрасте до 3 лет годичная выживаемость составляет 75,5% [97]. Функция почек может ухудшиться после трансплантации, что обусловлено не только применением циклоспорина. Часто развиваются инфекционные осложнения, особенно ветряная оспа, а также заболевания вызываемые вирусом EBV [86], микобактериями [79], грибами рода Candida [67] и CMV.
Иммунодепрессия
Обычно проводится многокомпонентная терапия, выбор протокола определяется конкретным трансплантационным центром. В большинстве клиник используют сочетание циклоспорина и кортикостероидов.
Циклоспорин можно назначать в предоперационном периоде перорально. При невозможности приёма препарата внутрь его вводят внутривенно. Назначение циклоспорина сочетают с внутривенным введением метилпреднизолона.
После трансплантации циклоспорин назначают внутривенно дробными дозами, если пероральный приём препарата окажется недостаточным. Параллельно внутривенно вводят метилпреднизолон, снижая его дозу до 0,3 мг/кг в сутки к концу 1 -и недели. Если возможно, терапию продолжают, назначая препарат перорально. В других трансплантационных центрах не применяют циклоспорин до трансплантации, но вместе с метилпреднизолоном назначают азатиоприн; циклоспорин начинают вводить, убедившись в адекватности функции почек. Длительную поддерживающую терапию обычно проводят циклоспорином в дозе 5—10 мг/кг в сутки.
К побочным эффектам циклоспорина относится нефротоксичность, однако клубочковая фильтрация через несколько месяцев обычно стабилизируется. Нефротоксичность усиливается при назначении таких препаратов, как аминогликозиды. Электролитные нарушения включают гиперкалиемию, гиперурикемию и снижение уровня магния в сыворотке. Возможны также артериальная гипертензия, уменьшение массы тела, гирсутизм, гипертрофия дёсен и сахарный диабет. В отдалённые сроки могут наблюдаться лимфопролиферативные заболевания. Возможно развитие холестаза. Нейротоксичность проявляется нарушениями психики, судорогами, тремором и головной болью.
Концентрация циклоспорина и такролимуса в крови может меняться при одновременном приеме других лекарственных препаратов (табл. 35-5).
Циклоспорин — дорогой препарат; из-за малой широты терапевтического действия необходим тщательный контроль за лечением. Следует определять его истинную концентрацию в крови, вначале часто, а затем регулярно через определённые интервалы времени. Выбор дозы основывается на нефротоксичности препарата. Побочные эффекты могут потребовать снижения дозы вплоть до замены циклоспорина азатиоприном.
Такролимус (FK506) — антибиотик из группы макролидов, несколько сходный по структуре с эритромицином. Этот препарат вызывает более сильное, чем циклоспорин, подавление синтеза интерлейки на-2 (ИЛ-2) и экспрессии рецептора ИЛ-2. Препарат использовался для спасения больных с повторными кризами отторжения трансплантированной печени [130]. По своему влиянию на
Таблица 35-5. Взаимодействие между циклоспорином (и такролимусом) и другими препаратами
Повышают концентрацию циклоспорина
Эритромицин
Кетоконазол
Кортикостероиды
Метоклопрамид
Верапамил
Дилтиазем
Такролимус
Снижают концентрацию циклоспорина
Октреотид
Фенобарбитал
Фенитоин
Рифампицин
Септрин (бактрим)
Омепразол
выживаемость реципиентов и жизнеспособность трансплантатов он сопоставим с циклоспорином [141]. Такролимус реже вызывает эпизоды острого и рефрактерного к лечению отторжения и необходимость в проведении кортикостероидной терапии. Однако число побочных эффектов, требующих прекращения лечения, больше, чем при терапии циклоспорином. К ним относят нефротоксичность, сахарный диабет, диарею, тошноту и рвоту. Неврологические осложнения (тремор и головная боль) при лечении такролимусом встречаются чаще, чем при использовании циклоспорина [41]. Основным показанием к назначению такролимуса остаётся рефрактерное отторжение.
Побочные эффекты азатиоприна — угнетение костного мозга, холестаз, пелиоз, перисинусоидальный фиброз и веноокклюзионная болезнь.
 2015-06-10
2015-06-10 688
688








