Всестороннее и целенаправленное исследование животных позволяет точно и в короткий срок разобраться в причинах бесплодия коров и телок, своевременно поставить диагноз, назначить правильное лечение и устранить причины, вызвавшие заболевание.
Клинико-гинекологическое диспансерное обследование коров и телок осуществляется путем проведения комплекса физиолого-клинических исследований половых органов и всех систем организма животных, лабораторных исследований крови, мочи, маточного содержимого с учетом анамнестических данных.
Анамнез. При сборе анамнеза выясняют:
- характер и продолжительность расстройств воспроизводительной функции;
- степень распространения болезней половых органов, возраст заболевших животных;
- систему организации искусственного осеменения;
- оплодотворяемость коров и телок и индекс осеменения;
- характер проявления половых циклов;
- результаты исследования на инфекционные и инвазионные болезни;
- перенесенные заболевания, используемые методы лечения;
- характер течения родового акта и инволюционных процессов в половых органах самок.
Анализируются также условия кормления, содержания и ухода. При анализе кормления проводят оценку рационов по их составу, процентному соотношению грубых, сочных и концентрированных кормов, по общей питательности, переваримому протеину, сахару, кальцию, фосфору, каротину, определяют сахаропротеиновое отношение, наличие токсических веществ и примесей солей тяжелых металлов. Эти сведения позволяют прогнозировать развитие тех или иных патологических процессов в половых органах.
При общем клиническом обследовании коров и телок учитывают упитанность, их поведенческие реакции, двигательную активность, состояние волосяного покрова, копытного рога, молочной железы, органов дыхания, пищеварения, сердечно-сосудистой системы. Одновременно путем осмотра определяют общую конфигурацию тела животных, состояние тазовых связок, вульвы, корня хвоста и промежности, наличие и характер выделений из половых органов, наличие экссудата или корочек на корне хвоста.
Для клинически здоровых животных характерны хорошая упитанность и общее состояние, блестящий волосяной покров, крепкий костяк, правильные формы копытец, постановка конечностей и походка.
Состояние половых органов у коров и телок определяют путем наружного, ректального и вагинального исследований.
При наружном исследовании выявляют признаки патологии в наружных половых органах, пальпируют и осматривают круп, поверхность бедер, корень хвоста.
Ректальное исследование коров и телок позволяет определить состояние матки и яичников и является очень важным диагностическим приемом для установления причин нарушения воспроизводительной функции животных.
У здоровых небеременных коров матка и яичники находятся в тазовой полости, оба рога почти одинаковой величины с ясно выраженной межроговой бороздкой. У многорожавших коров матка может быть несколько опущена в брюшную полость, а один из рогов незначительно увеличен. При пальпации матка заметно сокращается, уменьшается в размере, ее можно захватить рукой. Яичники подвижны, безболезненны, плотноэластической консистенции, в них можно определить фолликулы разной величины и желтые тела. Яйцеводы обычно не пальпируются. У телок матка и яичники меньшей величины, но хорошо пальпируются при ректальном исследовании. У стельных и бесплодных коров изменяется форма и величина матки, а также консистенция. В яичниках пальпируются желтые тела, кисты, иногда эти образования отсутствуют.
Диагностика болезней и функциональных нарушений яичников ректальным способом представляет некоторые затруднения, которые выражаются в трудоемкости выполнения пальпации яичников, не четко выраженных морфологических изменениях в зависимости от условий кормления, содержания и использования животных, недостаточности методического материала для ветеринарных специалистов.
Ниже мы приводим рисунки яичников коров в различные сроки полового цикла, на которых изображены изменения в яичниках в лютеиновой и фолликулярной фазах. Фотографии яичников подтверждены ультразвуковой диагностикой и схемами ее расшифровки, что дает более полную картину морфологических изменений.
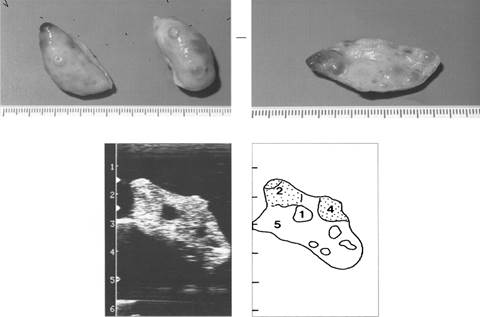 |
Рис. 1. Яичники на второй день полового цикла
(1- фолликул, 2- желтое тело, 4- желтое тело в состоянии регрессии, 5- строма яичника).
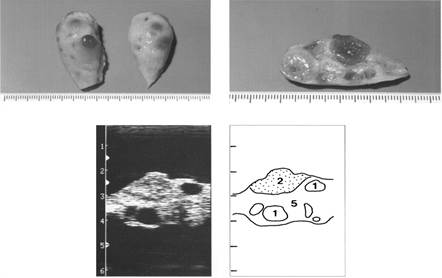 |
Рис. 2. Яичники на третий день полового цикла
(1- фолликул, 2- желтое тело, 5- строма яичника)
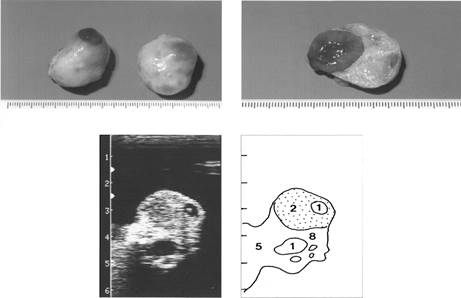 |
Рис. 3. Яичники на четвертый день полового цикла
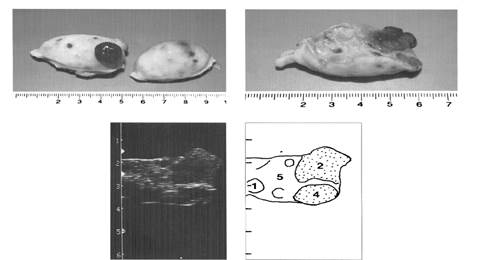 |
(1-фолликулы, 2- желтое тело, 5,8- строма яичника)
Рис. 4. Яичники на пятый день полового цикла
(1-фолликул, 2-4 желтое тело, 5- строма яичника)
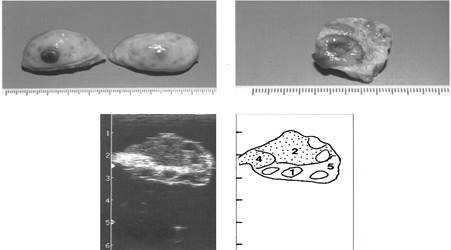 |
Рис. 5. Яичники на шестой день полового цикла
(1- фолликул, 2- желтое тело, 4- желтое тело в состоянии регрессии, 5- строма яичника)
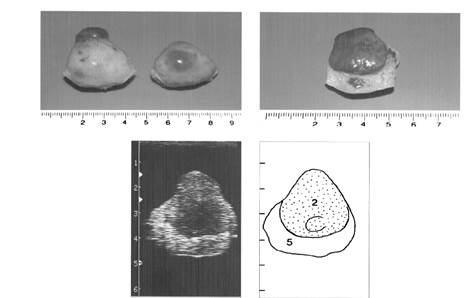 |
Рис. 6. Яичники на седьмой день полового цикла
(2- желтое тело, 5- строма яичника)
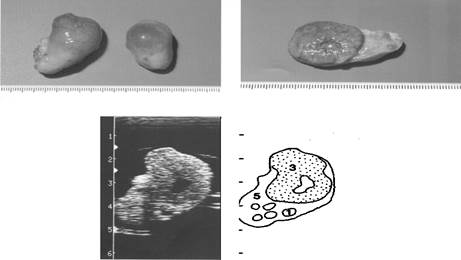 |
Рис. 7. Яичники на девятый день полового цикла
(1- фолликулы, 3- желтое тело, 5- строма яичника)
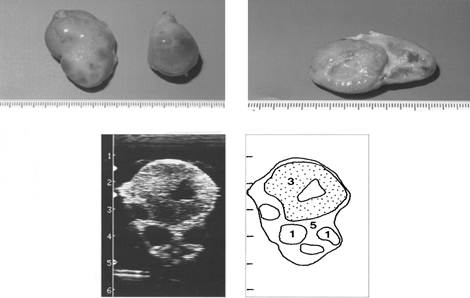 |
Рис. 8. Яичники на четырнадцатый день полового цикла
(1- фолликулы, 3-желтое тело с полостью внутри, 5-строма яичника)
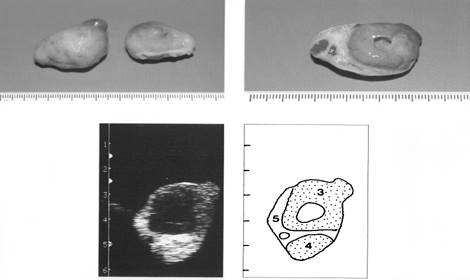 |
Рис. 9. Яичники на пятнадцатый день полового цикла
(3- желтое тело с полостью внутри, 4 – желтое тело в состоянии регрессии, 5- строма)
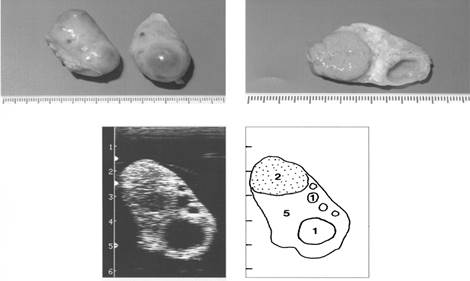 |
Рис. 10. Яичники на шестнадцатый день полового цикла
(1- фолликулы, 2 - желтое тело, 5- строма яичника)
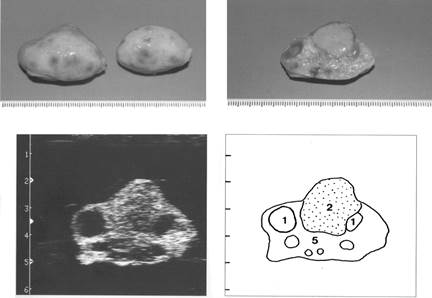 |
Рис. 11. Яичники на семнадцатый день полового цикла
(1- фолликулы, 2- желтое тело, 5- строма яичника)
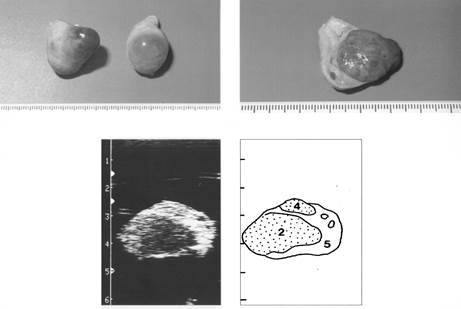 |
Рис. 12. Яичники на двадцатый день полового цикла
(2,4 желтое тело, 5- строма яичника)
Вагинальное исследование коров и телок проводят с помощью влагалищного зеркала. У здоровой коровы слизистая оболочка влагалища бледно-розового цвета, иногда с синюшным оттенком, блестящая и покрыта тонким слоем прозрачной или слегка опалесцирующей слизи. Шейка матки выступает во влагалище и имеет вид розетки, в складках которой скапливается слизь; канал шейки матки закрыт. Во время течки слизистая влагалища отечная, гиперемирована и покрыта прозрачной слизью, которая выделяется из влагалища в виде длинного тяжа; канал шейки матки слегка приоткрыт. Это исследование проводят не всегда, а по усмотрению врача с целью уточнения диагноза.
У бесплодных коров и телок состояние полового аппарата, особенно матки и яичников, сильно варьирует, в зависимости от формы бесплодия. Физиологические особенности организма влияют на состояние полового аппарата и динамику его изменения при нормальном и патологическом течении беременности, а также при заболеваниях. У коров патология полового аппарата нередко протекает с неясными клиническими признаками. Поэтому при постановке диагноза, кроме вагинального и ректального, используют и другие методы клинического, а также лабораторного исследования.
Ультразвуковая диагностика (УЗД). Основана на свойстве ультразвука распространяться в биологических средах с определенной и характерной для данной среды скоростью, а также свойстве отражаться от границ раздела тканей и сред, обладающих определенной величиной акустического сопротивления. применение в медицинской и ветеринарной практике ультразвуковой диагностической аппаратуры с частотой до 15 Мгц и интенсивностью 0,05-0,1Вт/см2 считается абсолютно безвредной для обследуемого биологического объекта в отличие от рентгенографического исследования. Этот метод отличается высокой информативностью, наглядностью получаемой информации, возможностью прижизненной морфологической оценки половых органов, простотой исполнения и обслуживания. УЗД используется в акушерстве и гинекологии ветеринарной медицины для диагностики беременности, болезней матки и яичников.
Для УЗД используются аппараты в основном зарубежного производства. Ультразвуковые аппараты выпускаются как в стационарном, так и в портативном вариантах. В республике Беларусь ультразвуковые аппараты изготавливает брестский электромеханический завод. На рисунках изображены ультразвуковые аппараты, применяемые с диагностической целью в ветеринарной медицине.
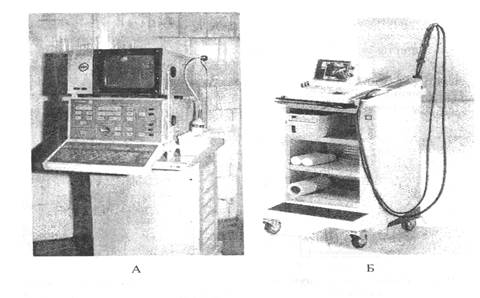
Рис. 13. Ультразвуковые аппараты.
А- эхотомоскоп ЭТС-У-2 производства Брестского электромеханического завода;
Б- ультразвуковой сканер DIAGNOST R2200 фирмы Philips.
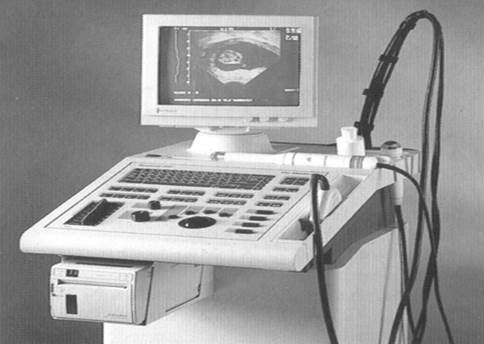
Рис.14. Стационарный сканер vet- 250
 |
Рис.15. Портативные аппараты для ультразвуковой диагностики 450— 460 vet.
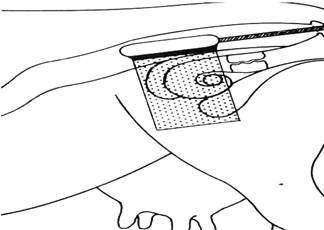 |
Вышеописанные приборы оснащены ультразвуковыми датчиками. Существует 4 метода электронного сканирования в реальном масштабе времени: секторное, линейное, трапециидальное и конвексное. Каждый метод характеризуется специфическими особенностями
Рис. 16. Ультразвуковая диагностика половых органов коровы.
в отношении поля наблюдения.
В последних конструкциях ультразвуковых приборов высокая разрешающая способность и четкость изображения обеспечиваются использованием широкополосных датчиков. Широкополосный эхофильтр обеспечивает оптимальную разрешающую способность за счет идеального сочетания частот с учетом поглощения эхосигналов, проходящих через мягкие ткани (Рис.16.)
Приборы обеспечивают цифровую обработку эхоизображения, содержат обширные пакеты программ расчета и протоколирования результатов исследования. Подробная техническая характеристика конкретного прибора дается в пакете сопроводительной документации, которой следует руководствоваться при эксплуатации.
Метод пертубации яйцеводов. Ректальное исследование состояния яйцеводов дает возможность установить только значительные изменения, при которых терапия уже не эффективна. В то же время начальные формы патологических процессов в них, которые поддаются лечению, можно диагностировать такими методами, как пертубация, хромо - гидротубация или их сочетание. Аппарат для пертубации состоит из манометра, шаров Ричардсона и катетера, на котором укреплен обтуратор для полного закрытия канала шейки матки. Все инструменты для пертубации (катетер, щипцы, влагалищное зеркало) должны быть стерильными. Корову фиксируют в станке, наружные половые органы дезинфицируют раствором фурациллина или марганцовокислого калия. В канал шейки матки вводят катетер, и обтуратором плотно закрывают канал ее для создания герметичности в полости матки. При вдувании воздуха шарами Ричардсона постоянно следят за стрелкой манометра. Давление доводят до 60 мм рт. ст., делают перерыв на 2 мин и постепенно повышают давление. Методом пертубации можно определить нормальную проходимость, сужение и непроходимость яйцеводов. Если яйцеводы проходимы, то стрелка манометра, поднявшись до деления 60—80 мм, начинает падать, так как воздух выделяется через брюшные отверстия труб и давление в полости матки падает. В случаях сужения и односторонней проходимости яйцеводов стрелка манометра медленно падает, когда достигает давления 80—100 мм рт. ст. При непроходимости яйцеводов доведение давления до 100—120 мм рт. ст. не дает эффекта, стрелка манометра удерживается на одном уровне. У коров максимальным давлением считают 100 мм рт. ст., у телок— 130 мм рт. ст.
Биопсия эндометрия в сочетании с гистологическим исследованием полученного материала позволяет установить бесплодие, обусловленное патологическими изменениями в матке коров и телок и протекающее без ясных клинических признаков. Особенно целесообразно проводить эти исследования у коров и телок, у которых половые циклы протекают регулярно с безрезультатным осеменением.
Бактериологическое исследование проводят для выявления в экссудате половых органов возбудителей трихомоноза, кампилобактериоза, хламидиоза, микоплазмоза, а также условно-патогенных микроорганизмов и грибов согласно существующим положениям с учетом особенностей роста того или иного микроорганизма.
Методика определения клеточного состава цервико-вагинальной слизи. Из цервикально-вагинальной слизи готовят мазки-отпечатки и окрашивают по Романовскому — Гимза. В мазке подсчитывают эпителиальные клетки большие (Б), средние (С), малые (М), безъядерные (Бя), деформированные (Дф). Наличие форменных элементов крови в слизи отмечают знаками + или — (обилие +++, умеренное количество ++, незначительное количество + и отсутствие —). В мазке подсчитывают 500 клеток.
При остром эндометрите в мазке преобладают средние клетки и появляются деформированные, при хроническом катаральном эндометрите содержится до 6 % безъядерных и до 55 % больших клеток, от 1 до 6 % деформированных при наличии небольшого количества клеток среднего размера. При фолликулярных кистах яичников количество средних эпителиальных клеток достигает 43—68 %, тогда как больших и малых бывает сравнительно мало, а безъядерные полностью отсутствуют. При кисте желтого тела и персистентном желтом теле наступает резкий сдвиг картины мазка вправо.
Проба осаждения для диагностики эндометритов (по Нагорному И. С. и Калиновскому Г. Н.). В пробирку наливают 2 мл содержимого, выделяющегося из матки и добавляют 2 мл 1%-ного раствора уксусной кислоты или раствора этакридина лактата (риваноля) 1: 1000. При нормальном течении послеродового периода образуется сгусток муцина, не разбивающийся при встряхивании, и осаждающаяся жидкость остается прозрачной. При послеродовом эндометрите образуется осадок, при легком встряхивании пробирки жидкость мутнеет.
Проба Катеринова на инволюцию матки. В пробирку наливают 3—5 мл дистиллированной воды и добавляют слизь величиной с горошину из шейки матки. Смесь кипятят 1—2 мин. При законченной инволюции матки жидкость остается прозрачной, а при субинволюции будет мутной с хлопьями.
Реакцию (рН) цервикальной слизи определяют с помощью рН-метра. При этом наиболее объективные данные получают при измерении рН слизи непосредственно в шейке матки коровы, что легко достигается во время стадии возбуждения. С помощью удлинителя через вагинальное зеркало электрод рН-метра вводят в канал шейки матки, не прикасаясь к ее стенкам. У стельных коров электрод прикладывают к слизистой пробке шейки матки. Нормальными показателями рН являются 7,1—7,8.
Экспресс-метод диагностики гипотонии матки и эндометритов у коров (по Дюденко В. С.). Метод основан на повышении содержания в лохиях и эстральной слизи индикана при нарушении сократительной способности матки и наличии токсических веществ ароматического ряда (индол, скатол и др.) при эндометритах.
Руку в полиэтиленовой перчатке или гинекологическую ложку Панкова вводят во влагалище, берут лохии или слизь около шейки матки и помещают в баночку или пробирку, на которой пишут номер и кличку коровы. Материал исследуют обычно сразу. Его можно хранить в прохладном месте 2—3 ч. Лохии берут у коров на 5—6-й день после осложненных родов, эстральную слизь— у коров, которые неоднократно осеменялись, в стадии возбуждения.
В пробирку наливают 5 мл лохий и добавляют 5 мл 20%-ного раствора трихлоруксусной кислоты, перемешивают и оставляют на 3—4 мин, а затем фильтруют через бумажный фильтр. В центрифужную пробирку помещают 4 мл фильтрата, доливают 1 мл 5%-ного раствора тимола, перемешивают, добавляют 6 мл реактива и оставляют на 1 ч. Потом в эту же пробирку приливают 1 мл смеси хлороформ-этилового спирта, перемешивают и центрифугируют 5 мин при 1—2 тыс. об./мин.
Оценка реакции: прозрачный хлороформ (—) — сокращение матки в пределах нормы; светло-розовый (+) — незначительное нарушение сократительной функции матки; розовый (++)—гипотония матки; розово-фиолетовый (+++) — гипотония или атония матки; фиолетовый (++++) —атония матки.
Для диагностики эндометритов в пробирку помещают 2 мл лохий или эстральной слизи, добавляют 2 мл 20%-ного раствора трихлоруксусной кислоты, перемешивают стеклянной палочкой и фильтруют через бумажный фильтр. К 2 мл фильтрата добавляют 0,5 мл азотной кислоты и осторожно кипятят 1 мин. После охлаждения к смеси приливают 1,5 мл 33%-ного раствора едкого натрия.
Оценка реакции: прозрачный раствор (—) — отсутствие воспаления матки; прозрачный с незначительным зеленоватым оттенком (+)—слабое воспаление матки; желто-зеленый (++)—легко протекающий катаральный эндометрит; янтарный (+++) —тяжелая форма катарального эндометрита; оранжевый (++++)—гнойно-катаральный эндометрит.
регистрация сокращений матки. Наиболее удобным является программно-аппаратный комплекс “ТОНИК-1” состоит из 3-х составных частей: датчики; устройство приема и преобразования сигнала от датчиков и передача данных на компьютер; программа обработки и распечатки данных. К системе возможно подключить одновременно 3 однотипных датчика, что вполне достаточно для исследования сокращений матки коровы. длина последовательно поставленных датчиков составляет 18-25 см. По своей функции датчик представляет собой резистор, который меняет свое сопротивление под действием силы, которая воздействует на его поверхность. По строению он состоит из ведущего стержня (из упругого материала), двух обмоток, полиэтиленовой оболочки и угля, заполняющего все пространство датчика. При надавливании на поверхность датчика пористый уголь спрессовывается, и сопротивление между обмотками изменяется.
Компьютер не может зафиксировать изменения сопротивления, так как он не обрабатывает аналоговый сигнал, он может только оперировать двумя импульсными уровнями сигнала, когда он есть, что соответствует “ 1 ”, и когда его нет, что соответствует “ 0 ”. Поэтому для того, чтобы передать значение сопротивления датчика на компьютер имеется устройство приема и преобразования сигнала от датчиков и передачи данных на компьютер.
Главной частью устройства является генератор пилообразных импульсов, частота которого изменяется в зависимости от сопротивления датчика. Эта зависимость стремится к прямой линии. Генератор пилообразных импульсов построен на микросхеме К155АГ3 - это сдвоенный ждущий мультивибратор. при подключении этого мультивибратора по предложенной схеме получается генератор импульсов.
Генератор формирует на своем прямом выходе короткие импульсы отрицательной полярности, на инверсном - положительные. Длительность импульсов примерно 50-100 нс. Период импульсов определяется по формуле T=0,32(R1+0,7)C1. Выход генератора, посредством транзистора КТ-315Б, подключенного в режиме электронного ключа, соединяется с одним из входов параллельного порта компьютера.
Программа, выполняющая обработку и распечатку данных, написана на языке Borland Pascal с применением ассемблерных вставок. дружественный, интуитивный интерфейс построен при помощи объектно-ориентированной оболочки Turbo-Vision 2.0. Запускной файл программы “Тonic1.exe”. Управлять действиями программы можно как клавиатурой, так и мышкой.
Программа настраивается под тип датчиков. Это дает возможность допускать большой расброс их параметров. Так же можно выбрать любое сочетание трех датчиков, которые включены во время опыта. Такая конструктивная особенность позволяет контролировать сокращения матки в любой её точке. После настройки программы и начала опыта компьютер переходит в режим графического отображения информации. Любое воздействие на датчик с небольшой задержкой в пределах 0,5 секунд (в параметры программы заложено, что частота выборки должна быть около 1 секунды) тут же отобразится на дисплее.
одновременно информация заносится в операционную память компьютера. После окончания опыта она переносится на винчестер. В дальнейшем можно произвести ее обсчет, то есть вычислить: общее количество сокращений, количество сокращений в 1 минуту, амплитуду, длительность и индекс сокращений.
Возможна распечатка гистерограммы от каждого датчика на принтер.
Условно работу с программно-аппаратным комплексом можно разделить на следующие периоды: запись сократительной функции матки, обсчет гистерограмм и вывод их и на принтер.
Для того, чтобы произвести запись сократительной функции матки, необходимо произвести следующую последовательность действий: перед включением компьютера подключить к параллельному порту (параллельный порт - этот разъем на задней стенке компьютера, куда обычно подключается принтер) устройство согласования датчиков с компьютером, включить компьютер. После его загрузки войти в каталог, где находится файл Tonic1.exe и запустить его. При выполнении программы на экране появится окно заставки с названием программы и реквизитами тех, кто ее разработал. Щелчком левой кнопкой мышки на клавише “Ок” или нажатием клавиши Enter, компьютер переводится в режим ожидания команд. В нижней строке экрана находится строка подсказки “Alt-X- Выход, F10 - Меню”. В верхней строке экрана размещено «меню пользователя», которое состоит из пунктов: Работа, Опции, Результаты.
Для того, чтобы начать опыт, необходимо соответствующим образом настроить программу под датчики (Рис. 17.). В начале надо указать, какие датчики будут участвовать в эксперименте.
 |
Рис. 17. Панель настройки датчиков
Для этого нажать клавишу F-10 ивойти в меню. клавишами “ “ и “®“ выбрать пункт “Опции” и нажать клавишу Enter. должно открыться вертикальное меню. Клавишами “”и “¯” выбрать пункт “Выбор датчиков” и нажать клавишу Enter. Того же самого результата можно добиться, если использовать клавишу F-5. На экране компьютера появится следующее диалоговое окно (Рис. 18.).
Используя клавиши Tab и пробел или мышку, пометить те датчики, которые нужно использовать в опыте. Клавишей Enter или мышкой на кнопке Ок закрыть диалоговое окно. Изменить параметры всех датчиков одновременно (например, при использовании компьютера с частотой, отличающейся от первоначальной) возможно через опцию “Общая настройка F6”. Порядок работы с окнами сохраняется прежний. Для индивидуальной настройки каждого датчика отдельно используются опции “Дифференцировка 1-го датчика F7”, “Дифференцировка 2-го датчика F8”, “Дифференцировка 3-го датчика F9”. После выбора этих опций на экране появится надпись “ Добейтесь минимального показания прибора и нажмите любую клавишу” и цифры. После установки постоянного показателя необходимо нажать клавишу Enter. Появится надпись “Добейтесь максимального показания прибора и нажмите любую клавишу”. Надавливанием на датчик добиться максимального цифрового значения и нажать Enter.

Рис. 18. Диалоговое окно выбора датчиков.
После всех настроек можно переходить к работе. Войти в меню “ Работа” и выбрать пункт “Запись сокращений F3” (Рис. 19.).
 |
Рис. 19. Диалоговое окно для записи сокращений матки.
После выбора этого пункта меню на экране появляется запрос на имя файла данных (для файла данных выбрано расширение «KUZ»). Необходимо задать имя файла в соответствии со спецификацией DOS и вести его. На дисплее происходит графическое отображение показаний датчиков.
На экране графически посредством линий разных цветов (красного, синего и белого) будут отображаться изменения давления миометрия на датчики. В то же время вверху экрана в окнах “ Сила сжатия 1-го (2-го, 3-го) датчика” будет показываться давление на датчик в данный момент времени. В окне “Имя файла” находится имя файла, в который будут записаны данные опыта. В окне «Время» регистрируется длительность опыта. Для того, чтобы приостановить опыт (например, чтобы изменить положение датчиков в матке коровы и т.п.), можно нажать клавишу «Пробел», а для продолжения опыта - любую другую клавишу.
При окончании работы необходимо нажать клавишу “ESC”.
Для распечатки гистерограмм необходимо в меню “Работа” выбрать пункт “Распечатка сокращений F4”. Клавишами “”и “¯” выбрать необходимый датчик и нажать “Enter”.
Ввести имя файла, в котором сохранены результаты опыта. Когда имя файла введено, нажать клавишу “Enter” (Рис. 20.). График будет распечатан.
Для расчета результатов опытов необходимо войти в меню “Результаты“ и выбрать пункт “Расчет”. Ввести имя файла для обсчета и нажать Enter (Рис.21.).
 |
Рис.20. Диалоговое окно для выбора распечатки с определенного датчика.
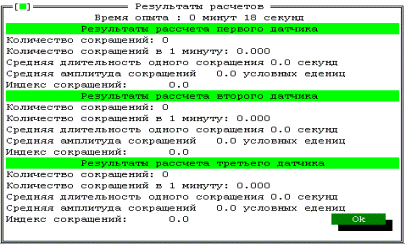 |
Рис. 21. Изображение на мониторе результатов обсчета.
Для того, чтобы выйти из программы, необходимо нажать комбинацию клавиш Alt-X.
Спермиоагглютинационная проба для выявления титра спермиоантител в сыворотке крови (по Братанову К. и Дикову В.). В 11 стерильных пробирок наливают по 1 мл физиологического раствора. В первую пробирку добавляют 1 мл сыворотки крови и смешивают с раствором. Затем 1 мл смеси переносят во вторую пробирку, из второй — в третью, и в такой последовательности продолжают разведение до 11-й пробирки, из которой 1 мл содержимого выливают. В результате получают разведение сыворотки крови в геометрической прогрессии— 1:1, 1:2, 1: 4, 1: 16, 1: 32, 1: 64, 1: 128, 1: 256, 1: 512, 1: 1024. В каждую пробирку добавляют по две капли 2%-ной суспензии спермиев быка, спермой которого неоднократно осеменяли корову. Содержимое пробирок смешивают и помещают на 30 мин в термостат при температуре +37 0 С.
Учет реакции проводят под микроскопом. Для этого на предметное стекло пастеровской пипеткой помещают небольшую каплю суспензии спермиев из каждой пробирки, накрывают покровным стеклом и рассматривают под микроскопом. Реакция считается отрицательной, если в поле зрения отсутствуют склеенные половые клетки или имеются единичные спермии, головки которых склеены; сомнительной—при агглютинации головок спермиев в разбавлении 1: 256 и ниже и положительной—при титре 1: 512 и 1: 1024 (все спермии склеены головками). У коров с нормальной плодовитостью титр спермиоагглютининов не превышает 1: 64, а у телок — 1: 32.
Биохимический анализ сыворотки крови включает определение каротина, общего белка, неорганического кальция и фосфора, резервной щелочности, углеводов и других необходимых веществ по методикам, описанным в специальных инструкциях и рекомендациях.
Морфологический анализ крови: определение содержания в ней эритроцитов, гемоглобина и лейкоцитов, выведение лейкограммы.
ОБЩИЕ ПОЛОЖЕНИЯ ПО ЛЕЧЕНИЮ ЖИВОТНЫХ С
АКУШЕРСКИМИ И ГИНЕКОЛОГИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ
В каждом крупном хозяйстве (колхозе, совхозе или комплексе) должен быть лечебный пункт, который является центром всей лечебной работы, проводимой врачом-гинекологом.
Лечебный пункт состоит из манежа, операционной, стационара, аптеки, кабинета врача и подсобных помещений (душевая, стерилизационная, фуражная и др.). К пункту подведена вода, оборудованы канализация и отопление. В манеже устанавливают станок для фиксации животных, а в операционной — операционные столы для крупных и мелких животных. Стационар соединяется с выгульной площадкой для моциона выздоравливающих животных. В стерилизационной комнате необходимо иметь автоклав, дистиллятор и стерилизаторы. В аптеке готовят основные лекарственные формы.
Лечебный пункт обеспечивается всеми необходимыми инструментами, медикаментами и оборудованием, на которые дает своевременно заявки врач-гинеколог. При лечебном пункте создают запас кормов для диетического кормления больных животных.
При лечении больных животных перед ветеринарным врачом стоят две задачи — сохранить жизнь, продуктивность самок и восстановить их плодовитость. Поэтому после постановки диагноза с учетом общего состояния больного животного врач составляет конкретный план лечения, который в случае необходимости можно изменить и дополнить.
Лечение должно быть направлено на удаление воспалительного экссудата из матки, восстановление сократительной функции миометрия и секреторной функции эпителия слизистой оболочки и маточных желез, подавление патогенных микроорганизмов, предотвращение интоксикации организма продуктами их жизнедеятельности и распада тканей, а также повышение защитных сил организма.
В ветеринарном акушерстве и гинекологии применяют следующие методы терапии:
патогенетическая терапия — из средств патогенетической терапии используют растворы новокаина или тримекаина, которые применяют путем внутриаортального, внутриперитонеального, внутритазового введения или в виде различных блокад проводящих нервных волокон, связанных с очагом воспаления.
Для внутриаортального и внутрибрюшинного введения новокаин применяется соответственно в 1%-ной и 10%-ной концентрации, а для блокад с лечебной целью 0,25 - 0,50%-ные растворы. Растворы новокаина готовят перед употреблением на 0,6 - 0,7%-ном растворе хлорида натрия или на жидкости Рингера в прописи А. В. Вишневского, включающей натрия хлорида 5 г, кальция хлорида 0,125, калия хлорида 0,075, воды дистиллированной 1000 г.
При новокаиновой терапии исключается применение антимикробных сульфаниламидных препаратов, так как в организме новокаин подвергается гидролизу с образованием парааминобензойной кислоты, которая нейтрализует бактериостатическое действие сульфаниламидов. В таком случае вместо новокаина необходимо использовать тримекаин, не обладающий подобным свойством.
Для лечения коров с заболеваниями матки используют следующие новокаиновые блокады:
— надплевральная новокаиновая блокада чревных нервов и симпатических пограничных стволов по В. В. Мосину. 0,5%-ный раствор новокаина в дозе 0,5 мл/кг массы тела вводят в равных количествах с правой и левой сторон в последнем межреберье в точке пересечения желоба, образованного подвздошно-реберным мускулом и длиннейшим мускулом спины с последним ребром;
— поясничная околопочечная (паранефральная) блокада по И. Г. Морозу. 0,25%-ный раствор новокаина в дозе 300 - 350 мл вводят между вторым и третьим поперечно-реберными отростками поясничных позвонков с правой стороны на 8 - 9 см ниже продольной линии, или по М. М. Сенькину: 0,25%-ный раствор новокаина в дозе 1 мл/кг массы тела вводят с правой стороны в промежутке между последним ребром и поперечным отростком первого поясничного позвонка или между поперечными отростками первого и второго поясничных позвонков, отступив на 1 - 1,5 см от свободных концов отростков к средней линии туловища;
— новокаиновая блокада тазового сплетения по А. Д. Ноздрачеву: 0,5%-ный раствор новокаина в дозе 1 мл/кг равными пропорциями с левой и правой сторон под широкие тазовые связки в области пересечения края слившихся поперечно-реберных отростков крестцовых позвонков с перпендикулярной линией, проведенной от резко выступающего в крестцовой гряде остистого отростка третьего крестцового позвонка или по А. И. Варганову: 1%-ный раствор новокаина в дозе 100 мл вводят на уровне четвертого крестцового позвонка на расстоянии 10 - 12 см от средней линии тела;
— пресакральная новокаиновая блокада по С. Г. Исаеву: 0,5%-ный раствор новокаина в дозе 0,5 - 1,0 мл/кг вводят в околоректальную клетчатку в средней точке между корнем хвоста и анусом;
— внутриаортальное введение 1%-ного новокаина в дозе 100 мл. пункция аорты осуществляется справа между четвертым и пятым поперечно-реберными отростками поясничных позвонков или внутрибрюшинное введение 10%-ного раствора новокаина в дозе 10 мл в области правой голодной ямки по Д. Д. Логвинову.
В зависимости от характера течения патологического процесса инъекции новокаина повторяют 2 - 3 раза с интервалом 48 - 96 ч.
В настоящее время становится актуальным вопрос применения физических факторов при лечении больных животных.
физиотерапия. Греческое слово «физиотерапия» (физис—природа и терапия—лечение) в переводе означает лечение природой, или, точнее, лечение естественными силами природы. Однако не все и не всегда разнообразные явления природы могут быть использованы в лечебных целях. Физиотерапия изучает лишь часть лечебных свойств физических факторов в их естественном или искусственном виде: холод, тепло, свет, воздух, воду, естественные водоемы, источники лечебных грязей, движение, электрическую и радиоактивную энергию. Несмотря на повсеместное наличие физических факторов, их не всегда можно применить для лечения животных в таком виде, в каком они существуют в природе. Например, купание животных в естественных условиях допустимо только в теплое время года и при наличии пригодных водоемов; использование солнечной энергии обусловливается состоянием погоды; из многообразия электрической энергии, магнитных полей, лазерного излучения для лечения избирают лишь те ее виды и формы, которые не причиняют вреда животному организму. Следовательно, природные физические факторы приходится приспособлять, уменьшать или усиливать их действие, дозировать. При помощи специальной аппаратуры можно искусственно создавать некоторые природные факторы независимо от времени суток, сезонных условий, места и окружающей среды.
На основе новейших технических достижений созданы сравнительно простые портативные, безопасные и легко управляемые аппараты, предназначенные для электросветолечения, магнито- и лазеротерапии. С другой стороны, новейшие открытия физики в области электричества, света, звука, радиоактивности очень быстро находят применение у биологов и физиотерапевтов. Так, например, было с лучами Рентгена, радиоактивными веществами, высокочастотными токами, с радиоволнами, ультразвуковыми колебаниями, магнитными полями и лазерными излучениями.
Широкие перспективы для физиотерапии открыли современные успехи биологии, физиологии, биохимии, патологической физиологии. Сюда относятся учение о биотоках, выяснение адаптационно-трофической роли нервной системы, учение о гуморальных медиаторах, выявление тонких биохимических процессов под влиянием внешних раздражений, новое освещение вопроса о патэргиях (аллергических, гипоэргических и гиперэргических) и признание главной роли макроорганизма в патологическом процессе.
Успех или неудача физиотерапевтических методов лечения во многом зависит от теоретической подготовки и клинического опыта врача. Помимо хорошей общеклинической подготовки, ему необходимо знать физическую природу избранного для лечения агента, его биологическое действие на здоровый и больной организмы и методику применения.
К физиотерапии следует подходить не менее осторожно и осмысленно, чем ко всякому другому лечебному методу—медикаментозному, хирургическому и др. При неумелом и нецелесообразном пользовании физическими агентами можно причинить больному организму вред, так же как при неправильном назначении сильнодействующих лекарственных веществ, хирургическом и прочем вмешательстве. Нужно отречься от ошибочных точек зрения по вопросам физиотерапии. Во-первых, нельзя смотреть на физиотерапевтический метод как на метод безобидный и безвредный; во-вторых, бесполезно прибегать к нему при необратимых патологических изменения х в тканях и органах; в-третьих, нельзя прибегать к нему тогда, когда другие методы не дали терапевтического эффекта. Подобные взгляды могут быть объяснены незнанием основ физиотерапии, что от нее можно ожидать и чего нельзя при той или иной конкретной форме заболевания животного.
В целом ряде случаев те или иные физические факторы и методы лечения, отличающиеся определенным биологическим действием, могут при различных патологических состояниях больного животного оказаться вредными и даже губительными. Например, неразумно назначать тепловые процедуры при кровоизлиянии в мозг и другие внутренние полости, а также при свежих лимфоэкстравазатах; нельзя применять массаж при гнойном, фибринозном и некротическом воспалении, поскольку этим приемом можно вызвать смерть животного от сепсиса.
С другой стороны, своевременное и правильное физиотерапевтическое вмешательство дает в одних случаях прямой лечебный эффект, в других может оказать важное вспомогательное влияние к основному методу лечения (медикаментозному или хирургическому), в третьих предупредить неблагоприятный исход болезни или предотвратить переход ее в хроническую, а иногда в неизлечимую форму.
Эффект физиотерапии во многом зависит от правильного выбора того или иного физического агента в соответствии с характером заболевания и стадийности его развития, т. е. имеет ли дело врач с острой, подострой, хронической или необратимой формой заболевания. Каждая из этих форм заболевания сопровождается различными функциональными и морфологическими изменениями тканей и органов. Поскольку физиотерапевтическое воздействие по существу является дополнительным раздражением рецепторного аппарата нервной системы, степень раздражения и место его применения должны быть адекватными функциональным и морфологическим изменениям.
Применению физических методов лечения должно предшествовать решение ряда задач практического порядка, сводящихся в основном к определению показаний: противопоказаний и целесообразности использования физических методов лечения при данном заболевании; лечебного метода на основе уточнения, с одной стороны, особенностей заболевания (этиология, патогенез, клиническое проявление), биологических и конституциональных черт больного животного, а с другой стороны, физико-химических и биофизических свойств того или иного физиотерапевтического агента, который должен обладать наибольшей терапевтической эффективностью при данном заболевании; дозировки и методических особенностей выполнения лечебной процедуры с учетом вида животного, степени функциональных расстройств и развития патологического процесса, возбудимости нервной системы; соответствия применяемого метода воздействия форме и стадии заболевания (острое, подострое и хроническое течение болезни); необходимости комбинированного лечения (электро-гидротерапия, электро-механотерапия, электро-грязелечение и т. п.); плана лечения—установление его продолжительности и частоты назначения процедур, необходимость одновременных дополнительных методов лечения (лекарственного, хирургического и др.); порядка постоянного и внимательного наблюдения за воздействием избранного физического агента на течение болезни с учетом конечных лечебных результатов на основе объективных клинических методов исследования.
Нельзя ожидать от физиотерапии сверхъестественных результатов и прибегать к ней как к последнему средству. При необратимых дегенеративных изменениях в органах и тканях она не может дать желаемого результата и заранее можно предвидеть неудачу и разочарование в этом методе.
Из сказанного видно, что физиотерапия требует от врача тонкой наблюдательности, искусства оценивать степень реактивности организма на тот или иной физический раздражитель и подбирать последний в соответствии с фазой патологического процесса.
Очень часто при физических методах лечения невозможно заранее предугадать характер и силу ответной реакции больного организма на ту или иную лечебную процедуру. Если медицинские врачи в таких случаях нередко руководствуются субъективными ощущениями пациента и придают им решающее значение, то ветеринарные работники лишены этой возможности. Это обязывает ветеринарного врача внимательно следить за поведением животного во время проведения лечебной процедуры, отмечать изменения течения болезни в лучшую или худшую сторону, своевременно вносить коррективы в намеченный план лечения, сменить один вид физиотерапевтической процедуры на другой, внести поправки в ее методику и дозировку.
Необходимо также учитывать, что ветеринарным врачам приходится иметь дело с различными видами животных, которым свойственны не только индивидуальные, но и видовые особенности. Физиологическая значимость тех или иных физиотерапевтических раздражителей для различных видов и групп животных весьма различна. Например, ветеринарным врачам хорошо известно, что кошки очень плохо переносят гидротерапию и фенольные препараты; крупный рогатый скот - ртутные препараты; лошади очень чувствительны к электрическому току низкой частоты. Следует также учитывать и сезонные физиологические процессы, например линьку. Если в пастбищный период животные подвергаются интенсивному солнечному облучению, то в зимний (стойловый) период недостаточность ультрафиолетового облучения вызывает серьезные нарушения в обменных процессах. Бесполезно подвергать ультрафиолетовому облучению овец с густым шерстным покровом.
При проведении физиотерапевтических процедур важно считаться с проявлениями беспокойства у больных животных, попавших в непривычную обстановку и подвергаемых необычным воздействиям. В этих случаях следует широко пользоваться условными рефлексами, усвоенными животными в течение их жизни. Первое неумелое проведение электропроцедуры, вызвавшей электрический удар и испуг у животного, может в значительной степени осложнить дальнейшее лечение этим методом.
Многие физиотерапевтические процедуры требуют обеспечения полной безопасности больных животных, обслуживающего персонала и сохранности аппаратуры.
Чтобы выработать стойкий положительный рефлекс на ту или иную физиотерапевтическую процедуру, нужно исключить все беспокоящие и отвлекающие животное элементы, не допускать грубых движений при его фиксации; лечебные процедуры желательно назначать в одно и то же время рабочего дня; после проведения процедуры в целях поощрения полезно дать животному какое-либо лакомство. При соблюдении этих несложных правил больные животные без особого принуждения заходят в фиксационные станки, собаки сами прыгают на процедурный стол, позволяют без сопротивления наложить электроды и т. д.
Ветеринарный специалист должен выработать у себя качества неторопливости и терпения, изжить суету и нервозность при непослушании или сопротивлении животного, относиться к нему ласково.
Необходимо отметить и теневую сторону некоторых физических методов лечения, требующих большой затраты труда и времени. Казалось бы, проще заменить их лекарственными веществами. Однако никакими другими средствами и методами нельзя заменить специфические свойства диатермии, электрического поля ультравысокой частоты, ультразвуковой терапии для прогревания глубоко залегающих органов и тканей. Ни одним лекарством нельзя заменить массаж и функциональную терапию. К тому же физиотерапия применяется преимущественно при подострых и хронических заболеваниях, которые сами по себе требуют длительного лечения любыми средствами и методами.
Из физических методов лечения коров с патологическими процессами в матке используют акупунктуру, представляющую собой разновидность рецепторной и нейростимулирующей терапии, а также электромагнитные токи УВЧ, КВЧ, СВЧ, лазеротерапия, магнитотерапию. В основе их лежит рефлекторный и нейрогуморальный механизм лечебного действия.
Акупунктура выполняется путем воздействия на биологически активные точки с помощью иглоукалывания, электропунктуры, криопунктуры. При иглоукалывании продолжительность процедур составляет 15 - 20 мин, при электропунктуре каждая необходимаяточка(4 - 8 точек) обрабатывается 1,5 - 2 мин и криопунктуре — 2 - 3 с.
УВЧ-терапия коров осуществляется с помощью прибора ЛГЗ-1. УВЧ путем ректальной аппликации излучателя при мощности 30 Вт, ежедневной 10-минутной экспозиции в течение 8 - 10 мин.
Лазеротерапию проводят с помощью прибора СТП-3 низкоинтенсивным лазерным импульсом (средняя мощность не более 0,1 Вт с длиной волны 0,87 - 0,97 Нм) путем ректальной аппликации излучателя на 1 - 2 мин в течение 6 - 8 дней (В. П. Иноземцев, И. И. Балковой), или аппарата лазерной терапии «УЛЕЙ-2К-СПОРТ» с импульсным лазерным лучом 0,89 – 0,92 мкм, частотой 2000 Гц, средней мощностью 4,2 Вт, экспозицией 3-5 минут с интервалом 24 часа путем использования вагинального и наружных излучателей (Р.Г. Кузьмич и др.).
Магнитотерапия проводится с использованием импульсного магнитного поля (аппарат ГИМ-В) индукцией 2 – 2,5 Тл, частотой 1 Гц, экспозицией 5 минут с интервалом 24 часа воздействуя на шейку матки и область крестца с помощью наружного и вагинального соленоидов (Р.Г. Кузьмич и др.).
Стимулирующая терапия. Из средств общестимулирующего действия для повышения биологического тонуса и иммунной реактивности организма, нормализации обмена веществ используют тканевые биогенные стимуляторы, ихтиол, цитрированную кровь, витаминные препараты, кальция хлорид, глюкозу и др.
Тканевые препараты, приготовленные по методу В. П. Филатова из печени, селезенки, плаценты и других органов, вводят коровам подкожно в дозе 20 - 30 мл с интервалом 5 - 7 дней. При гемотерапии используют аутокровь (аутогемотерапия по Г. В. Зверевой), кровь от клинически здоровых, ранее переболевших эндометритом животных (изогемотерапия по Е. В. Ильинскому), или гипериммунную кровь от специально подготовленных коров-доноров путем гипериммунизации их вакцинами, приготовленными из "местных" штаммов патогенных микроорганизмов, выделяемых от больных эндометритом коров (иммуногемотерапия по А. Г. Нежданову). Кровь, консервированную лимоннокислым натрием (из расчета 50 мл 10%-ного раствора на 0,85%-ном растворе хлорида натрия на 1 л крови), вводят подкожно 4 - 6 раз в дозах 75, 100, 125, 150, 125, 100 мл с интервалом 48 - 72 ч. С целью снижения негативного действия крови к первой дозе добавляют 25 мл 4 %-ного раствора новокаина.
Если аутогемотерапию считают разновидностью активной общестимулирующей терапии, то изогемотерапию, и особенно иммуногемотерапию, следует относить в разряд не только средств общего действия, но и специфического антимикробного действия за счет присутствия в крови специфических иммуноглобулинов (А. Г. Нежданов, М. Т. Коняев).
Ихтиол в качестве общестимулирующего действия используют в виде 7%-ного стерильного раствора, приготовленного на 0,85%-ном растворе натрия хлорида или 40%-ном растворе глюкозы. Раствор ихтиола инъекцируют коровам подкожно в подогретом до 37 - 40°С виде шестикратно с интервалом 48 ч в повышающе-понижающихся дозах: 20, 25, 30, 35, 25 мл (В. Д. Мисайлов).
С этой же целью показано парэнтеральное применение по 25 мл второй фракции антисептика-стимулятора Дорогова (АСД), очищенного гаммаглобулина молозива с интервалом 3 - 5 дней.
В качестве биогенного стимулятора рекомендуется применять препарат из торфа – БСТ – 1 подкожно, внутримышечно или паравагинально по 20 мл на 100 кг массы тела животного, или каролин внутримышечно по 40 мл семь дней подряд с интервалом 24 часа (Р.Г. Кузьмич).
Глюкозу в виде 40%-ного раствора в дозе 150 - 200 мл и кальция хлорид 10%-ной концентрации в дозе 100 - 120 мл вводят внутривенно в течение 2 - 3 дней. При септических процессах показано применение жидкости Кадыкова (камфара — 4 г, глюкоза — 60 г, спирт этиловый — 300 мл, 0,85%-ный раствор натрия хлорида — 700 мл) внутривенно 2 раза в день по 200 - 300 мл.
Витаминные препараты (А — 0,7 - 1,0 млн ИЕ, Д — 70 - 100 тыс. ИЕ, Е — 500 - 700 мг, С — 2 - 3 г) скармливают с концентрированными кормами дважды с интервалом 7 - 10 дней.
Для лечения животных с дисфункцией яичников используют препараты гонадотропных гормонов (гравогормон, сывороточный гонадотропин, СЖК, КЖК, ХГ, ФСГ, ЛГ и др.), простагландинов Ф-2 альфа (эстуфалан, клатрапростин, гравопрост, гравоклатран, биоэстрофан и др.) и гонадолиберинов (сурфагон). В определенных случаях применяют также нейротропные препараты (прозерин, карбахолин) и препараты гормонов яичников (прогестагены, эстрогены).
Гормональные препараты нормализуют эндокринную и генеративную функцию яичников, повышают сократительную функцию матки, активизируют в ней пролиферативно-секреторные процессы и обеспечивают восстановление плодовитости коров и телок.
Этиотропная терапия. В качестве средств этиотропной терапии, направленной на подавление жизнедеятельности патогенной микрофлоры, используют нитрофурановые, сульфаниламидные и антибиотические препараты в различных сочетаниях и различных лекарственных формах. Из готовых лекарственных средств используют: тилозинокар, метритил, неофур, лефуран, гистеротон, йодгликоль, йодоксид, эндофарм, метромакс, эмульсию йодвисмутсульфамида, левотетрасульфин, левоэритроциклин, спумосан, мастисаны А, В, Е, дифурол, и др. При их отсутствии используют линимент стрептоцидный или синтомициновый с добавлением в объемную дозу неомицина или мономицина 1,0 г и окситетрациклина 1,0 г, 10%-ную суспензию трициллина на жировой основе; суспензию на жировой основе, содержащую в объемной дозе, фурацилина — 1,0, фуразолидона — 0,5, неомицина — 1,5, пенициллин — 1,0 и норсульфазол — 5,0 или окситетрациклин — 1,5, неомицин — 1,5, полимиксин М — 0,15 и норсульфазол — 5,0; 5%-ную суспензию фуразолидона или 2,5%-ную суспензию фурагина, приготовленную на 2%-ном растворе метилцеллюлозы.
Антимикробные препараты в виде свечей, таблеток, палочек вводят в полость матки по 3 - 5 шт., а в жидкой форме с помощью стерильного шприца Жанэ, полистироловых осеменительных пипеток и резиновой трубки или прибора для искусственного осеменения свиней (ПОС-5, ВИЖ), предварительно срезав утолщение на конце катетера. Препараты вводят в дозах 75 - 100 мл подогретыми до 37 - 40°С. Фармакопрепараты на пролонгированной основе (левоэритроциклин, левотетрасульфин, спумосан) назначают с интервалом 4 - 5 дней, а другие с интервалом 24 - 48 ч.
Из биологических средств подавления жизнедеятельности микробов в матке используют препарат биосан, представляющий собой бульонную или высушенную культуру вагинальных лактобацилл человека (А. И. Варганов).
Антимикробные средства рекомендуется вводить в полость матки утром, после освобождения ее от экссудата.
При септическом состоянии коровам, кроме того, внутримышечно вводят бициллин-3 или бициллин-5.
Выбор лекарственных средств осуществляют на основании определения чувствительности к ним микроорганизмов. Контроль на чувствительность повторяют через каждые 2 - 3 месяца их использования.
Отбор проб цервикальной слизи или маточного содержимого для идентификации микроорганизмов и определения их чувствительности к фармакологическим препаратам осуществляют по методике Н. Н. Михайлова. Для этого используют стерильную одноразовую полистироловую пипетку для осеменения коров, соединенную резиновой трубкой со шприцем, в который набирают 2 мл стерильного физраствора натрия хлорида. После обработки наружных половых органов влагалище раскрывают стерильным зеркалом и через него в канал шейки матки вводят пипетку на глубину 2 - 3 см, впрыскивают физраствор, а затем всасывают его обратно с цервикальной слизью или экссудатом. Взятые пробы над пламенем спиртовки сливают в стерильные пробирки, содержащие 1 мл физраствора, закрывают стерильными пробками, помещают в термос со льдом и доставляют в лабораторию не позднее 6 ч после взятия. Данный метод получения биологического материала для лабораторных исследований используется и для исключения инфекционных и инвазионных заболеваний (трихомоноз, кампилобактериоз, листериоз, хламидиоз и др.).
Молоко от коров в период лечения антибиотиками, сульфаниламидами и нитрофуранами, а также после его завершения, в пищу человека не допускается в течение 3 - 8 суток, а используется после кипячения для скармливания животным.
Учитывая широкое распространение лекарственноустойчивых штаммов микробов, вызывающих воспалительные процессы в матке, и значительную изменчивость антимикробной эффективности различных лекарственных препаратов, отрицательное действие многих из них на слизистую оболочку матки и длительное выделение их с молоком, в лечении коров, больных эндометритом необходимо отдавать предпочтение этиотропно-патогенетическим методам.
Симптоматическая терапия. В качестве средств симптоматической терапии, направленной на повышение тонуса миометрия, усиление сократительной деятельности матки, удаление из ее полости патологического содержимого, используют миотропные и нейротропные препараты: окситоцин, питуитрин, ацеклидин, сферофизин, бревиколин, метилэргометрин, допростон, углекислый экстракт гвоздики пищевой, БСТ – 1, карбахолин, прозерин и др.
Окситоцин и питуитрин вводят подкожно в дозах 40 - 50 ЕД, 0,2%-ный раствор ацеклидина в дозе 3 - 5 мл, 1%-ный раствор сферофизина бензоната— 4 - 10 мл, 1%-ный раствор бревиколина— 40 - 50 мл, 0,02%-ный раствор метилэргометрина — 5 - 6 мл, 0,5%-ный раствор прозерина или 0,1%-ный раствор карбахолина — 2 - 2,5 мл, допростон внутримышечно в дозе 5 мл, экстракт гвоздики пищевой внутрь 4 - 5 мл с питьевой водой, БСТ – 1 – в паравагинальную клетчатку в дозе 100 мл. Препараты назначают ежедневно в течение 3 - 5 суток до восстановления сокращений матки.
Так как воспалительные процессы в матке снижают ее чувствительность к миотропным препаратам, то их рекомендуется применять на фоне эстрогенов (В.Д. Мисайлов), которые обеспечивают активизацию энергетических и пластических процессов в матке, снижают активность окситоциназы, что создает оптимальные условия для утеротонического действия окситоцина и других утеротонических соединений. Кроме того, эстрогены, усиливая митоз эпителиальных клеток в матке и их секреторную активность, способствуют повышению резистентности пораженных тканей к действию патогенных факторов.
В качестве эстрогенных препаратов используют 1-2%-ный масляный раствор синестрола соответственно в дозе 4 - 5 мл и 2 - 2,5 мл, 0,1%-ный раствор эстрадиолдипропионата или агофоллин 2,5 – 3,0 мл. Препараты вводят внутримышечно 1 - 2 раза с интервалом 24 ч.
Миотропные и нейротропные препараты назначают на ночь, так как в период ночного покоя матка более активно реагирует на них, а продолжительный ночной отдых животного в лежачем положении создает оптимальные условия для освобождения полости матки от патологического содержимого.
хирургические методы терапии — энуклеация персистентного желтого тела, раздавливание и пункция кист яичников, овариоэктомия, фетотомия, кесарево сечение и др.;
комплексные методы терапии —сочетание нескольких методов (этиотропная, патогенетическая терапия и др.).
При терапии следует учитывать растворимость, совместимость с другими препаратами, отсутствие токсического действия, степень проникновения через биологические барьеры и накопление в очаге поражения, а также противовоспалительное, бактерицидное и микотическое действие.
Широко используют в ветеринарной гинекологии готовые лекарственные формы: свечи, палочки, эмульсии, растворы и др.
За больными животными ведут постоянное наблюдение, при отсутствии сдвигов в течении патологического процесса следует изменить метод лечения с учетом состояния больного животного. Больных ежедневно чистят, особое внимание обращая на чистоту наружных половых органов и вымени; подстилка должна быть чистой и обильной, особенно в случае вынужденного длительного лежания больного. Моцион животным предоставляют с учетом общего состояния и течения заболевания. Назначают диетическое кормление с добавлением в рацион витаминных, минеральных и других препаратов.
АНДРОЛОГИЧЕСКАЯ ДИСПАНСЕРИЗАЦИЯ
Андрологическая диспансеризация - это исследование производителей по определенному плану, позволяющее установить форму импотенции, определить прогноз и провести лечебные и профилактические мероприятия.
После регистрации производителя собирают анамнестические данные: время содержания в хозяйстве или на племпредприятии, уход и содержание, рацион кормления, половой режим, количественные и качественные показатели спермы, оплодотворяемость коров, выход телят по зоне обслуживания; время появления полового расстройства, его проявление, особенно степень нарушения половых рефлексов; применяемое лечение и его эффективность; благополучие по инфекционным и инвазионным заболеваниям; ветеринарные обработки.
При общем исследовании определяют конституцию, упитанность, темперамент, выраженность вторичных половых признаков. Состояние органов пищеварения, дыхания, кровообращения, нервной системы определяют общепринятыми методами исследования. Особое внимание обращают на суставы, копытца, мышцы. При исследовании половых органов определяют состояние семенников, придатков, семяпроводов, мошонки препуциального мешка и пениса. При необходимости проводят ректальное исследование придаточных половых желез — простаты и пузырьковидных, а также ампул семяпроводов.
У животных с хорошей и высокой воспроизводительной способностью (плодовитостью) мошонка симметрична, безболезненна, без повреждений, с хорошо выраженной подвижностью слоев, семенники симметричны или с асимметрией не более 5 – 10%, продольно-овальной формы с хорошей выпуклостью наружу, упруго эластичной консистенцией, с гладкой поверхностью и хорошей подвижностью, безболезненны. У взрослых быков величина каждого семенника находится в пределах, см: длина — 11 - 20, ширина — 6,5 - 10,5, толщина — 7,0 - 10,5. Головка, тело и хвост придатка хорошо выражены, эластичны, семенные канатики симметричны, эластичны, подвижны. Крайняя плоть хорошо прилегает к брюшной стенке, свисающая часть небольших размеров, без повреждений, припухлостей и болезненности. Половой член подвижен, без механических повреждений, воспалений, персистирующей уздечки и новообразований. Тело предстательной железы пальпируется в виде поперечного валика размером 1 - 1,5 см, плотно эластичной консистенции. Пузырьковидные железы плотно эластичной консистенции, симметричны, с хорошо выраженной дольчатостью длиной 10 - 12 см и толщиной до 5 см. Ампулы спермиопроводов пальпируются над мочевым пузырем в виде продольного веретенообразного утолщения длиной 13 - 15 см и толщиной 4 - 8 см. Луковичные и уретральные железы не прощупываются.
При проведении андрологических обследований производителей (и выполнении лечебных процедур) необходимо соблюдать особую осторожность. В целях обеспечения безопасности и хорошего доступа к исследуемым органам целесообразно использовать специальные средства успокоения животных и обезболивания.
Наиболее опасным и технически сложным для выполнения является исследование половых органов у производителей, поэтому следует применять нейролептики (2—6%-ный аминазин, рометар, калипсовет и др.).
При получении спермы на искусственную вагину следят за степенью проявления половых рефлексов—эрекции, обнимательного, совокупительного и рефлекса эякуляции.
Выраженность половых рефлексов у быков-производителей оценивают по 4-балльной шкале на основании учета времени, силы и характера их проявления.
Половое возбуждение (локомоторный рефлекс): 4 балла — бык быстро подходит к животному, стоящему в станке манежа, или к механическому чучелу и любыми путями пытается сделать садку; 3 — бык спокойно подходит к станку для взятия спермы; 2 — бык неохотно приближается к животному в станке; 1 — при подводке к станку бык не проявляет признаков активности; 0 — бык уходит от станка.
Рефлекс эрекции: 4 балла — состояние эрекции наступает в течение 1 - 5 с при направлении быка к станку для взятия спермы; 3 — эрекция наступает в течение 30 с после подвода быка к станку, и тут же проявляются другие рефлексы; 2 — эрекция наступает в течение 1 – 2 мин после подвода быка к станку; 1 — эрекция наступает только после вспрыгивания на быка в станке или на механическое чучело; 0 — отсутствие эрекции.
Обнимательный рефлекс (рефлекс фиксирования): 4 балла — при подходе к станку бык сразу же делает прыжок на животное или чучело и выделяет сперму; 3 — бык делает прыжок на другого быка сразу же после подвода к станку, но неохотно сходит с животного (чучела) после эякуляции, продолжительность обнимательного рефлекса длится до 1 мин; 2 — обнимательный рефлекс проявляется спустя 1 - 2 мин после подхода быка к станку; 1 — бык не делает прыжка более 3 мин; 0 — отсутствие обнимательного рефлекса.
Совокупительный рефлекс: 4 балла — бык делает сильный и энергичный толчок при первом же прыжке в течение 2 - 3 с; 3 — бык делает сильный и энергичный толчок после повторного прыжка; 2 — бык делает несколько прыжков и совокупительных движений, полный рефлекс проявляется в течение 1 мин с момента прыжка, толчок слабо выраженный; 1 — толчок вялый, чуть заметный; 0 — торможение рефлекса.
Рефлекс эякуляции: 4 балла — объем эякулята у взрослых быков 4 - 5 мл и более, у молодых 3 - 4 мл; 3 — объем эякулята 3 - 4 мл (у молодых быков — 2 - 3 мл); 2 — объем
 2015-06-14
2015-06-14 12678
12678
