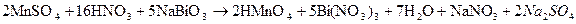
Mn2+ + 4H2O – 5e→MnO4- + 8H+ *2
BiO3- +2e + 6H+ →Bi3+ + 3H2O *5
Опыт 4. Окислительные и восстановительные свойства соединений марганца (IV).
А. Окислительные свойства диоксида марганца.
MnO2+4HCl→MnCl2+Cl2↑+2H2O
желтый газ
Mn4+ +2e→Mn2+ *1
2Cl- -2e→Cl2 *1
Б. Восстановительные свойства диоксида марганца.
MnO2+KNO3+2NaOH→Na2MnO4+KNO2+H2O
Mn4+ -2e + 4OH-→MnO42- + 4H+ *1
NO3- +2e + H2O→NO2‑ + 2OH- *1
Опыт 5. Окислительные свойства перманганата калия.
А. Кислая среда.
1. 2KMnO4+8H2SO4+10KI→2MnSO4 + 5I2 +6K2SO4 + 8H2O
красноватая жидкость
MnO4- + 5e + 8H+ →Mn2+ + 4H2O *2
2I- -2e →I20 *5
2. 2KMnO4+8H2SO4+10FeSO4→5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
обесцвечивание
MnO4- + 5e + 8H+ →Mn2+ + 4H2O *1
Fe2+ -e →Fe3+ *5
3. 2KMnO4+3H2SO4+5Na2SO3→2MnSO4+5Na2SO4+K2SO4+3H2O
темно-синяя жидкость
MnO4- + 5e + 8H+ →Mn2+ + 4H2O *2
SO32- - 2e +H2O →SO42- + 2H+ *5
Б. Нейтральная среда.
1. 2KMnO4+3Na2SO3+H2O→2MnO2+3Na2SO4+2KOH
темно-фиолетовая жидкость
MnO4- + 3e +2H2O →MnO2 + 4OH- *2
SO32- - 2e +H2O →SO42- + 2H+ *3
2MnO4-+4H2O+3SO32- +3H2O→2MnO2+8OH- +3SO42- +6H+
2MnO4-+7H2O+3SO32-→2MnO2+8OH- +3SO42- +6H+
2. 2KMnO4+3MnSO4+2H2O→5MnO2+2H2SO4+K2SO4
зелено-коричневая жидкость
MnO4- + 3e + 2H2O →MnO2 + 4OH- *2
Mn2+ - 2e +2H2O →MnO2 + 4H+ *3
2MnO4-+4H2O+3Mn2++6H2O→2MnO2+8OH- +3MnO2+12H+
2MnO4-+3Mn2++10H2O→2MnO2+8OH- +3MnO2+12H+
В. Сильнощелочная среда.
KMnO4+KOH+Na2SO3→K2MnO4+H2O+K2SO4
светло-фиолетовый
MnO4- + e →MnO42- *2
SO32- - 2e + 2OH- →SO42- + H2O *1
2MnO4-+SO32-+2OH- →2MnO42-+SO42-+H2O
 2015-06-14
2015-06-14 2276
2276








