Строение атома (на примере меди):
Все элементы побочных подгрупп являются d-элементами (это самое многочисленное семейство в таблице Менделеева), так как в их атомах последним заполняется d-подуровень.
У элементов I группы побочной подгруппы наблюдается проскок электрона, например, у атома меди один электрон с 4s-подуровня переходит на 3d-подуровень, где не хватает одного электрона до завершения слоя.
Основное состояние:



|
 Cu
Cu  2e 8e 18e 1e
2e 8e 18e 1e
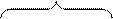  | ↑↓ | ||||||||||||||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ |
 | ||||||||
| ↑↓ | ↑↓ | ↑↓ |
| ||||||||||||||
| |||||||||||||||||
 1s
1s
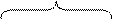  | ↑ | ||||||||||||||||
| ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ |
  | ||||||||
| ↑↓ | ↑↓ | ↑↓ |
| ||||||||||||||
| |||||||||||||||||
1s
Электронная формула: 1s22s22p63s23p63d104s1
Характерные валентности меди: I и II.
Характерные степени окисления меди: 0, +1, +2.
Для серебра наиболее характерна валентность I и степень окисления 0 и +1 (в редких случаях встречаются валентность II и степень окисления +2).
Для золота характерны валентности I и III и степени окисления 0, +1, +3.
Отрицательных степеней окисления, как и все металлы, не имеют, так как электроотрицательность низкая и забрать электроны у других элементов не могут.
| Медь (Cu): | Серебро (Ag): |
| Металл красного (розового) цвета, очень ковкий и пластичный. | Блестящий серебристо-белый, мягкий и пластичный металл. |
| Обладает высокой тепло- и электропроводностью (второе место после серебра) и низким сопротивлением. | Самый электропроводный среди всех металлов. |
Нахождение в природе:
1. В свободном состоянии медь и серебро встречаются, но достаточно редко.
2. В земной коре содержатся в виде солей:
- CuS – ковеллин;
- Cu2S – медный блеск;
- FeCuS2 – халькопирит;
- (CuOH)2CO3 – малахит;
- Ag2S – серебряный блеск.
Получение:
1. В промышленности: чаще всего обжигают сульфидные руды, в результате чего они переходят в оксиды, которые подвергают действию различных восстановителей (C, CO, H2):
2CuS + 3O2 → 2CuO + 2SO2
CuO + C → Cu + CO
При обжиге сульфидов серебра ввиду нестойкости оксида Ag2O при высокой температуре непосредственно получается металл: Ag2S + O2 → Ag + SO2
2. В лаборатории: из солей Fe + CuSO4 → FeSO4 + Cu↓
В химических реакциях медь и серебро, как и другие металлы, выступают в роли восстановителей.
Так как химическая активность элементов в побочных подгруппах, в отличие от главных, уменьшается с ростом заряда ядра их атомов, медь является более активным металлом, чем серебро.
| Медь (Cu) | Серебро (Ag) |
| I. Взаимодействие с простыми веществами. 1. Как и большинство металлов, медь и серебро, взаимодействуют с наиболее активными неметаллами, например, с галогенами: | |
| Cu + Cl2 → CuCl2 | 2Ag + Cl2 → 2AgCl |
| 2. Относительно легко взаимодействуют с серой, образуя соответствующие сульфиды: | |
| Cu + S → CuS (t=400°C) 2Cu + S → Cu2S (t >400°C) | 2Ag + S → Ag2S (при нагревании) |
| 3. Медь, в отличие от серебра взаимодействует и с кислородом: | |
| 2Cu + O2 → 2CuO (t=400 - 500°C) 4Cu + O2 → 2Cu2O (t >1000°C) | Ag + O2 ≠ |
| II. Взаимодействие с кислотами. Так как медь и серебро стоят в ряду напряжений правее водорода, они взаимодействуют только с кислотами, являющимися сильными окислителями – азотной и концентрированной серной кислотой: | |
| Cu + HCl ≠ Cu + H2SO4(разб.) ≠ 3Cu + 8HNO3(разб.) → 3Сu(NO3)2 + 2NO↑ + 4H2O Cu + 4HNO3(конц.) → Сu(NO3)2 + 2NO2↑ + 2H2O Cu + 2H2SO4(конц.) → СuSO4 + SO2↑ + 2H2O | Ag + HCl ≠ Ag + H2SO4(разб.) ≠ 3Ag + 4HNO3(разб.) → 3AgNO3 + NO↑ + 2H2O Ag + 2HNO3(конц.) → AgNO3 + NO2↑ + H2O 2Ag + 2H2SO4(конц.) → Ag2SO4 + SO2↑ + 2H2O |
| III. Особые свойства. | |
| В сухом воздухе медь при обычной температуре не изменяется, но во влажном воздухе постепенно реагирует с водой, кислородом и углекислым газом с образованием зеленой основной соли (CuOH)2CO3: 2Cu + H2O + CO2 + O2 → (CuOH)2CO3 | Серебряные предметы чернеют, если в воздухе есть примесь сероводорода: 4Ag + 2H2S + O2 → 2Ag2S + 2H2O |
Качественные реакции на катионы меди (II):
1. С раствором аммиака (гидроксидом аммония):
CuSO4 + 4NH4OH → [Cu(NH3)4]SO4 + 4H2O
синий раствор
сульфат тетраамминмеди (II)
2. С раствором желтой кровяной соли (гексацианоферрата (II) калия):
2CuSO4 + K4[Fe(CN)6] → Cu2[Fe(CN)6]↓ + 2K2SO4
желтая кровяная соль красно-бурый осадок
гексацианоферрат (II) калия гексацианоферрат (II) меди (II)
Качественные реакции на катион серебра (I):
1. С соляной кислотой или хлоридами:
AgNO3 + HCl → AgCl↓ + HNO3
белый творожистый осадок
Осадок растворяется в растворе аммиака:
AgCl + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
хлорид диамминсеребра (I)
При добавлении кислоты снова выпадает белый творожистый осадок:
[Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3
2. С иодидами: AgNO3 + KI → AgI↓ + KNO3
светло-желтый осадок
3. С дихроматом калия: 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3
кирпично-красный осадок
4. С тиосульфатом натрия: 2AgNO3 + Na2S2O3 → Ag2S2O3↓ + 2NaNO3
белый осадок
Ag2S2O3 + H2O → Ag2S↓ + H2SO4
черный осадок
5. Со щелочами: 2AgNO3 + 2KOH → Ag2O↓ + H2O + 2KNO3
грязно-коричневый осадок
 2015-06-14
2015-06-14 1358
1358







