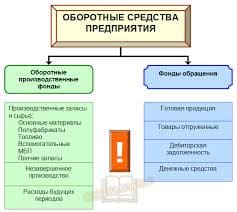
48. основные понятие супрамолекулярной химии.Типы взаимодействия в супрамолекулярных системах.Молекулярное распознование: «принцип замок ключ» Супрамолекулярная химия (от лат. supra – над) – это междисциплинарная область науки, изучающая химические, физические и биологические аспекты более сложных, чем молекулы, химических систем.История создания. Основоположниками супрамолекулярной химии принято считать нобелевских лауреатов по химии за 1987 г. Ч. Педерсена, Д. Крама (США) и Ж.-М. Лена (Франция) [65]. Ч. Педерсен отрыл в 1962 г. краунэфиры – макроциклические полиэфиры, способные образовывать с катионами щелочных и щелочноземельных металлов прочные комплексы, которые можно выделить в кристаллическом виде. Следующим шагом стало открытие в 1967 г. Ж.-М. Леном криптандов – аминоэфиров, имеющих трехмерную сфероидальную полость, в которую может быть заключен связываемый ион, благодаря чему возникают более прочные комплексы, чем в случае плоских макроциклов.Д. Крам обратил внимание на существенный недостаток и краун-эфиров, и криптандов: их структура как бы сморщена, что затрудняет прием «гостевых»ионов. Крам решил сконструировать более подходящие «молекулыконтейнеры». В результате этой работы в начале 1980-х гг. были получены кавитанды. Творцы супрамолекулярной химии:Чарльз Педерсен (1904–1989), Дональд Крам (1919–2001), Жан-Мари Лен (род. 1939)Aвтором термина «супрамолекулярная химия» является Ж.-М. Лен. Вот данное им определение: «Супрамолекулярная химия – это “химия за пределами молекулы”, изучающая структуру и функции ассоциаций двух или более химических частиц, удерживаемых вместе межмолекулярными силами». В настоящее время принято считать, что объектами изучения супрамолекулярной химии являются супрамолекулярные ансамбли, строящиеся путем самосборки из комплементарных, т. е. имеющих геометрическое и химическое соответствие, фрагментов.Предмет изучения. Если классическая химия имеет дело с реакциями, в ходе которых происходит разрыв и образование валентных связей между атомами, то в супрамолекулярной химии связи между супрамолекулами носят невалентный характер. Это: ван-дер-Ваальсова связь, водородная связь, электростатическая связь, а также эффекты влияния среды [67–69]. Супрамолекулы состоят из рецептора и субстрата, где субстрат – меньший по размеру компонент, вступающий в связь. Субстратов может быть несколько. Связь рецептора и субстрата носит характер молекулярного распознавания по типу «замок – ключ». Основными типами рецепторов являются криптанды, кавитанды и каликсарены. Криптанды – это бициклические азотсодержащие эфиры, атомы азота которых способны координировать катионы металлов внутри образовавшейся полости (от греч. cryptos – скрытый). Кавитанды – это макроциклы, состоящие из нескольких бензольных колец, поверхности которых образуют полости (от лат. cavitas – пустота). Каликсарены – это продукты циклической олигомеризации фенола с формальдегидом, внешний вид которых напоминает чашу (от лат. calix – чаша). Основными видами супрамолекул являются следующие: комплексы типа «гость – хозяин», ротаксаны, катенаны (рис. 8.1, 8.2). Ротаксаны – супрамолекулы, составленные из двух частей: циклической и линейной по типу «колесо – ось». Роль «оси» играет линейная часть супрамолекулы, а роль «колеса» – ее циклическая часть. При этом «колесо» может не только вращаться вокруг «оси», но и совершать вдоль нее колебательные движения. Соскочить с «оси» «колесо» не может, благодаря наличию на ее концах своеРис. 8.1. Супрамолекулярный комплекс типа «гость – хозяин» [69] образных «заглушек». Катенаны – супрамолекулы, в которых циклические части продеты одна в другую подобно звеньям цепи. 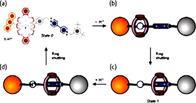 Рис. 8.2. Схематическое изображение ротаксанов Возникающие в результате ассоциации супрамолекул супрамолекулярные ансамбли подразделяются на мицеллы, везикулы, мембраны, жидкие кристаллы и другие типы структур. Мицеллы – это частицы, окруженные слоем молекул или ионов (от лат. micella – крошечка). Везикулы – это супрамолекулярные ансамбли, содержащие внутри себя пустоты, заполненные какими-либо растворенными веществами (от лат. vesicula – пузырек). Мембраны часто имеют вид молекулярного сита (рис. 8.3).
Рис. 8.2. Схематическое изображение ротаксанов Возникающие в результате ассоциации супрамолекул супрамолекулярные ансамбли подразделяются на мицеллы, везикулы, мембраны, жидкие кристаллы и другие типы структур. Мицеллы – это частицы, окруженные слоем молекул или ионов (от лат. micella – крошечка). Везикулы – это супрамолекулярные ансамбли, содержащие внутри себя пустоты, заполненные какими-либо растворенными веществами (от лат. vesicula – пузырек). Мембраны часто имеют вид молекулярного сита (рис. 8.3). 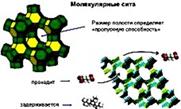 Рис. 8.3. Разновидность мембраны – молекулярное сито [69] К числу возникающих путем самосборки твердых супрамолекулярных соединений относятся клатраты и интеркалаты. Клатраты – это супрамолекулярные соединения, состоящие из кристаллической решетки «хозяина», в полостях которой находятся молекулы, атомы или ионы «гости» (от лат. clathratus – защищенный решеткой (клеткой)). Интеркалаты – это соединения, образующиеся в результате внедрения (интеркаляции) каких-либо реагентов в межслоевое пространство кристаллических веществ со слоистым типом структуры (от лат. intercalatus – вставленный). На рис. 8.4 показано кристаллическое строение клатратов.
Рис. 8.3. Разновидность мембраны – молекулярное сито [69] К числу возникающих путем самосборки твердых супрамолекулярных соединений относятся клатраты и интеркалаты. Клатраты – это супрамолекулярные соединения, состоящие из кристаллической решетки «хозяина», в полостях которой находятся молекулы, атомы или ионы «гости» (от лат. clathratus – защищенный решеткой (клеткой)). Интеркалаты – это соединения, образующиеся в результате внедрения (интеркаляции) каких-либо реагентов в межслоевое пространство кристаллических веществ со слоистым типом структуры (от лат. intercalatus – вставленный). На рис. 8.4 показано кристаллическое строение клатратов. 
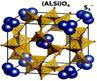 Рис. 8.4. Структура клатрата (слева) и ее пример структура природного синего пигмента ультрамарина. Анионы серы располагаются в пустотах содалитовой клетки [69] 8.2. Супрамолекулярная химия и нанотехнологии Супрамолекулярная химия и самоорганизация. Наноразмерный характер супрамолекул, их способность к самосборке и самоорганизации находят естественное применение при создании наноматериалов, о которых шла речь в разделе 6. Пониманием внутреннего единства синергетики, нанонауки и супрамолекулярной химии была пронизана лекция нобелевского лауреата Ж.-М. Лена «Нанонаука и нанотехнологии. Подход самоорганизации», прочитанная им на 26 июня 2008 г. на пленарном заседании Санкт-Петербургского научного форума «Наука и общество. Нанотехнологии: исследования и образование» [66]. В своем докладе Ж.-М. Лен остановился на создании двумерных металлосупрамолекулярных решеток, способах разметки супрамолекулярных электронных компонентов, трехмерных супрамолекулярных структурах: решетках, цилиндрах и других аспектах приложения супрамолекулярной химии к нанотехнологиям. Супрамолекулярный дизайн. Одним из перспективных научных направлений, возникших на стыке супрамолекулярной химии и нанотехнологий, является инженерия кристаллов или супрамолекулярный дизайн. Основная идея инженерии кристаллов – конструирование периодических структур с необходимой супрамолекулярной организацией, позволяющей реализовать в создаваемом материале желаемое свойство. Универсального решения основополагающей проблемы инженерии кристаллов – каким должен быть элементарный блок, чтобы получить кристалл с желаемыми структурой и свойствами, – на сегодняшний день не существует. Однако разработаны следующие подходы, позволяющие использовать и контролировать слабые связи между супрамолекулярными частицами: – принцип плотной упаковки Китайгородского; – правила Эттер для водородных связей; – концепция супрамолекулярного синтона – характерного способа связности между группами соседних молекул; – концепция тектона – молекулы, образующей в кристалле сильные направления взаимодействия. Молекулярный дизайн лежит в основе поучения «разумных» наноматериалов с управляемой самоорганизацией. На внешние воздействия (облучение, изменение кислотности среды, электрический ток и т. п.) такие материалы реагируют изменением окраски, температуры, формы и других свойств. Одним из достижений в этой области является создание тонких пленок перовскита – окисла, содержащего свинец, цирконий и титан. Эти пленки обладают сильным электрокалорическим эффектом: при уменьшении приложенного напряжения на 25 В материал охлаждается на 12º. Такие устройства (кулеры) могут найти применение для охлаждения компьютерных микросхем, в автомобильной и космической промышленности, в кондиционерах и бытовых холодильных установках, а также биотехнологических системах (сенсорах и системах формирования изображений).
Рис. 8.4. Структура клатрата (слева) и ее пример структура природного синего пигмента ультрамарина. Анионы серы располагаются в пустотах содалитовой клетки [69] 8.2. Супрамолекулярная химия и нанотехнологии Супрамолекулярная химия и самоорганизация. Наноразмерный характер супрамолекул, их способность к самосборке и самоорганизации находят естественное применение при создании наноматериалов, о которых шла речь в разделе 6. Пониманием внутреннего единства синергетики, нанонауки и супрамолекулярной химии была пронизана лекция нобелевского лауреата Ж.-М. Лена «Нанонаука и нанотехнологии. Подход самоорганизации», прочитанная им на 26 июня 2008 г. на пленарном заседании Санкт-Петербургского научного форума «Наука и общество. Нанотехнологии: исследования и образование» [66]. В своем докладе Ж.-М. Лен остановился на создании двумерных металлосупрамолекулярных решеток, способах разметки супрамолекулярных электронных компонентов, трехмерных супрамолекулярных структурах: решетках, цилиндрах и других аспектах приложения супрамолекулярной химии к нанотехнологиям. Супрамолекулярный дизайн. Одним из перспективных научных направлений, возникших на стыке супрамолекулярной химии и нанотехнологий, является инженерия кристаллов или супрамолекулярный дизайн. Основная идея инженерии кристаллов – конструирование периодических структур с необходимой супрамолекулярной организацией, позволяющей реализовать в создаваемом материале желаемое свойство. Универсального решения основополагающей проблемы инженерии кристаллов – каким должен быть элементарный блок, чтобы получить кристалл с желаемыми структурой и свойствами, – на сегодняшний день не существует. Однако разработаны следующие подходы, позволяющие использовать и контролировать слабые связи между супрамолекулярными частицами: – принцип плотной упаковки Китайгородского; – правила Эттер для водородных связей; – концепция супрамолекулярного синтона – характерного способа связности между группами соседних молекул; – концепция тектона – молекулы, образующей в кристалле сильные направления взаимодействия. Молекулярный дизайн лежит в основе поучения «разумных» наноматериалов с управляемой самоорганизацией. На внешние воздействия (облучение, изменение кислотности среды, электрический ток и т. п.) такие материалы реагируют изменением окраски, температуры, формы и других свойств. Одним из достижений в этой области является создание тонких пленок перовскита – окисла, содержащего свинец, цирконий и титан. Эти пленки обладают сильным электрокалорическим эффектом: при уменьшении приложенного напряжения на 25 В материал охлаждается на 12º. Такие устройства (кулеры) могут найти применение для охлаждения компьютерных микросхем, в автомобильной и космической промышленности, в кондиционерах и бытовых холодильных установках, а также биотехнологических системах (сенсорах и системах формирования изображений).
=========================================================================
49,Основные положения теории химического строения органических соединений.Взаимное влияние атомов в молекуле. Индукционный и мезомерные эффекты. Электронные смещения в органических соединениях подразделяют на два вида: индуктивный эффект — смещение электронной плотности по цепи ст-связей и мезомерный эффект — смещение по системе п-связей. Индуктивный эффект. Рассматривая типы химических связей, мы отмечали, что между атомами с одинаковой электроотрицательностью пара электронов связи в равной мере принадлежит обоим атомам (ковалентная неполярная связь). Например, связи в молекулах метана, бутана — неполярные, электронная плотность в них распределена симметрично, и молекула не имеет дипольного момента. Если же в молекуле бутана один атом водорода заместить на галоген — хлор, то электронная плотность связи С—С1 смещается к более электроотрицательному атому хлора (ковалентная полярная связь): 5"'+ 5"+ 5,+ 5+ 5- 4 3 2 1 0 Н3С—СН2—СН2—СН3 Н3С9СН29СН29СН29С1 и-бутан, ц = 0 1-хлорбутан, 0 Пара электронов ст-связи С—С1 принадлежит как углероду, так и хлору, но несколько смещена к хлору, поэтому хлор приобретает частично отрицательный заряд 5-, а атом углерода связи — равный по величине частично положительный заряд 5+. Уменьшение электронной плотности на С1 приводит к тому, что последний, проявляя акцепторные свойства, смещает на себя электроны о-связи от соседнего атима углерода. происходит ии-ляризация связи С2—С1, и частичный пштожительный заряд возникает также на С, чти в свию ичередь ведет к поляризации связи С2—С3 и визникнивению частичниги пилижительниги заряда на С, и т. д. При этим дрибный пилижительный заряд на атомах углерида в цепи ит С1 ди С4 уменьшается: 5+ > 5'+ > 5"+ > 5"'+. Пиляризация идний связи углерод-галоген вызывает пиляри-зацию милекулы в целим и, следивательни, пиявление дипильни-ги мимента. Индуктивный (индукционный) эффект — передача электронно-ги влияния заместителя вдоль цепи ст-связей, китирая визникает в силу различний электриитрицательнисти атимив. Индуктивный эффект обозначается буквой I, а смещение электронной плотности изображают с помощью стрелки вдоль простой ст-связи, острие которой указывает на направление смещения. Пи направлению электринниги влияния заместителей различают положительный +I и отрицательный -I индуктивный эффекты. Отрицательный индуктивный эффект проявляют заместители, притягивающие электроны ст-связи, например: —NO2, —C=N, —COOH, —Hal, —OH. Отрицательный индуктивный эффект, как правило, увеличивается с ростом электроотрицательности атомов. Он сильнее выражен для заместителя с трийний связью, так как в еги систаве нахи-дится более электроотрицательный sp-гибридизированный атом углерода. В свою очередь атом углерода в sp -гибридизации, как менее электроотрицательный, в составе заместителя проявляет
отталкивающие от себя электроны ст-связи, чаще всего это ал-кильные группы (Alk). Электронодонорные свойства у алкильных заместителей возрастают с ростом длины углеводородной цепи (—С4Нд > —СН3) и увеличиваются при переходе от первичных к третичным радикалам ((СН3)3С— > (СН3)2СН— > СН3СН2— > > СН3—). Последнее объясняется тем, что индуктивный эффект затухает по цепи. +1 по отношению к атомам углерода в sv- и sv -гибридизации: 2. Химическая связь. Взаимное влияние атомов в органических соединениях 27 ^^шмиу^л вылшиеиз.ложенное, кра|ки остановиммся на I основнытх свойствах индуктивного эффекта: 1. Индуктивный эффект проявляется лишь при наличии в молекуле атомов с различной электроотрицательностью. 2. Индуктивный эффект распространяется только через ст-свя-зи и в одном направлении. 3. Индуктивный эффект быстро затухает по цепи. Максимум его действия — четыре ст-связи. 4. Индуктивное смещение определяется наличием дипольного момента: ц^ 0. Мезомерный эффект (эффект сопряжения). Прежде чем рассматривать передачу электронного влияния заместителей по системе п-связей, определим понятия сопряженная система и сопряжение.
Сопряженной называется система, в которой имеет место чередование простых и кратных связей, или система, в которой при атоме углерода с кратной связью находится атом, имеющий вакантную орбиталь или неподеленную пару электронов. Сопряженные системы бывают с открытой и замкнутой цепью сопряжения: Н2С=СН—СН=СН2 СН2=СН—С1 бутадиен-1 хлорэтен СН—СН  аллильнып катион нашталин Сопряженные системы называется еще конъ-ютированнхыми, а цепи сопряжения — цепями конъюгации (от лат. перекрывание, наложение). В них имеет место сопряжение — дополнительное перекрывание п- и р-АО, имеющих параллельные оси симметрии (компланарные). За счет сопряжения происходит перераспределение (делокализация) п-электронной плотности и образование единой п-электронной системы. В зависимости от вида перекрываемых орбиталей различают несколько видов сопряжения: п,п-сопряжение (перекрывание двух п-орбиталей), р,п-сопряжение (перекрывание р- и п-орбиталей) (рис. 2.9). Сопряжение энергетически выгодный процесс, протекающий с выделением энергии. Сопряженные системы характеризуются повышенной термодинамической устойчивостью.
аллильнып катион нашталин Сопряженные системы называется еще конъ-ютированнхыми, а цепи сопряжения — цепями конъюгации (от лат. перекрывание, наложение). В них имеет место сопряжение — дополнительное перекрывание п- и р-АО, имеющих параллельные оси симметрии (компланарные). За счет сопряжения происходит перераспределение (делокализация) п-электронной плотности и образование единой п-электронной системы. В зависимости от вида перекрываемых орбиталей различают несколько видов сопряжения: п,п-сопряжение (перекрывание двух п-орбиталей), р,п-сопряжение (перекрывание р- и п-орбиталей) (рис. 2.9). Сопряжение энергетически выгодный процесс, протекающий с выделением энергии. Сопряженные системы характеризуются повышенной термодинамической устойчивостью.
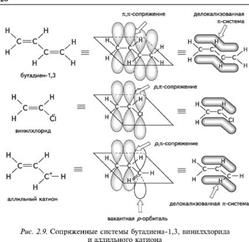
дав определение сопряжению и сопряженным системам, рассмотрим электронные эффекты, которые наблюдаются при введении в такие системы различного рода заместителей. Эффект сопряжения, или мезомерный эффект (М), — процесс передачи электронного влияния заместителя по сопряженной системе п-связей. Смещение электронной плотности в сопряженных системах возможно лишь при включении в систему электронодо-норных или электроноакцепторных заместителей. Например, в молекуле бензола имеется сопряжение, но нет заместителей, поэтому мезомерный эффект отсутствует. В молекуле фенола гидроксигруппа входит в сопряженную систему, и в такой системе имеет место мезомерный эффект. В молекуле бензилового спирта —ОН-группа изолирована от сопряженной системы группой —СН2, поэтому со стороны —ОН-группы мезо-мерный эффект проявляться не будет. 2. Химическая связь. Взаимное влияние атомов в органических соединениях 2 
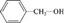 мезомерный эффект обозначают буквой М1, а смещение элек- тронной плотности в сопряженной системе изогнутой стрелкой. По направляющему действию заместителя мезомерный эффект делится на положительный (+М) и отрицательный (-М). Положительный мезомерный эффект (+М) проявляют атомы и атомные группы, имеющие неподеленные пары электронов или отрицательный заряд (доноры электронов):
мезомерный эффект обозначают буквой М1, а смещение элек- тронной плотности в сопряженной системе изогнутой стрелкой. По направляющему действию заместителя мезомерный эффект делится на положительный (+М) и отрицательный (-М). Положительный мезомерный эффект (+М) проявляют атомы и атомные группы, имеющие неподеленные пары электронов или отрицательный заряд (доноры электронов):  мухаксиммольный +±± у атомов с отрицательным зарядом. заместители, содержащие неподеленные пары электронов, имеют тем больше +М, чем меньше в пределах периода электроотрицательность атомов, содержащих неподеленные пары электронов. Отрицательный мезомерный эффект (-М) проявляют заместители, смещающие на себя электронную плотность сопряженной системы:
мухаксиммольный +±± у атомов с отрицательным зарядом. заместители, содержащие неподеленные пары электронов, имеют тем больше +М, чем меньше в пределах периода электроотрицательность атомов, содержащих неподеленные пары электронов. Отрицательный мезомерный эффект (-М) проявляют заместители, смещающие на себя электронную плотность сопряженной системы: 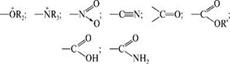 Максимальный -М проявляют заместители, несущие положительный заряд. Рассмотрим несколько примеров проявления мезомерного эффекта со стороны заместителей:
Максимальный -М проявляют заместители, несущие положительный заряд. Рассмотрим несколько примеров проявления мезомерного эффекта со стороны заместителей:

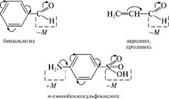
Мезомерный эффект по сравнению с индук1ивным вызывает более сильное смещение электронной плотности и практически не затухает по цепи. Совместное проявление индуктивного и мезомерного эффектов заместителя. Мезомерный и индуктивный эффекты одного заместителя могут совпадать или не совпадать по направлению. На- пример, в молекуле акролеина альдегидная группа
Являет М, а гидроксильная группа в молекуле фенола обладает —1, но +м -эффектом. 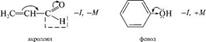 лак видно из приведенного примера, в молекуле фенола противоположное электронное смещение приводит к тому, что эти два эффекта как бы «гасят» друг друга. А в молекуле акролеина индуктивный и мезомерный эффекты усиливают друг друга. Ме-зомерный эффект заместителя обычно больше, чем индуктивный, так как п-связи поляризуются легче, чем а-связи. Поляризация, обусловленная мезомерным эффектом, имеет альтернирующий характер: под влиянием заместителя смещаются не только п-электронные облака, но и облака а-связей. Это явление наблюдается в системах с открытой и замкнутой цепью сопряжения:
лак видно из приведенного примера, в молекуле фенола противоположное электронное смещение приводит к тому, что эти два эффекта как бы «гасят» друг друга. А в молекуле акролеина индуктивный и мезомерный эффекты усиливают друг друга. Ме-зомерный эффект заместителя обычно больше, чем индуктивный, так как п-связи поляризуются легче, чем а-связи. Поляризация, обусловленная мезомерным эффектом, имеет альтернирующий характер: под влиянием заместителя смещаются не только п-электронные облака, но и облака а-связей. Это явление наблюдается в системах с открытой и замкнутой цепью сопряжения: 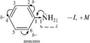 про 2. Химическая связь. Взаимное влияние атомов в органических соединениях лотя аминогруппа проявляет —1-эффект, вызывает понижение электронной плотности на всех атомах углерода ароматического цикла, но за счет +М-эффекта, который больше -1, наблюдается повышение электронной плотности в целом в бензольном кольце, особенно в положениях 2, 4, 6. Таким образом в сопряженной системе возникает альтернирующий (чередующийся) заряд. В молекулах с открытой цепью сопряжения максимальные заряды сосредоточены по концам сопряженной системы: 8+ ^ 8'- 8'+ ^8-; Н2С=СН—СЖ4 акрилонитрил Эффект сверхсопряжения (гиперконъюгация). Наряду с п,п-и р, п-сопряжением имеет место особый вид сопряжения — а,п-сопряжение (гиперконъюгация, или сверхсопряжение). Эффект сверхсопряжения — взаимодействие, которое возникает при перекрывании электронных облаков ст-орбиталей связей С—Н с п-орбиталями кратной связи. Такой вид перекрывания электронных облаков представляет собой а,п-сопряжение (рис. 2.10). Смещение электронов а-связей при этом изображают с помощью изогнутой стрелки. Любая из а-связей метильной группы пропе-на может участвовать в а,п-сопряжении. а.тс-сопряжение
про 2. Химическая связь. Взаимное влияние атомов в органических соединениях лотя аминогруппа проявляет —1-эффект, вызывает понижение электронной плотности на всех атомах углерода ароматического цикла, но за счет +М-эффекта, который больше -1, наблюдается повышение электронной плотности в целом в бензольном кольце, особенно в положениях 2, 4, 6. Таким образом в сопряженной системе возникает альтернирующий (чередующийся) заряд. В молекулах с открытой цепью сопряжения максимальные заряды сосредоточены по концам сопряженной системы: 8+ ^ 8'- 8'+ ^8-; Н2С=СН—СЖ4 акрилонитрил Эффект сверхсопряжения (гиперконъюгация). Наряду с п,п-и р, п-сопряжением имеет место особый вид сопряжения — а,п-сопряжение (гиперконъюгация, или сверхсопряжение). Эффект сверхсопряжения — взаимодействие, которое возникает при перекрывании электронных облаков ст-орбиталей связей С—Н с п-орбиталями кратной связи. Такой вид перекрывания электронных облаков представляет собой а,п-сопряжение (рис. 2.10). Смещение электронов а-связей при этом изображают с помощью изогнутой стрелки. Любая из а-связей метильной группы пропе-на может участвовать в а,п-сопряжении. а.тс-сопряжение 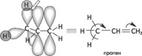 rue. 2.iu. ^хема перекрывания а-ороиталеи связи ^—п с п-орОиталью кратноИ связи в молекуле пропена Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой. Понятие о сверхсопряжении объясняет повышенную реакционную способность, подвижность а-водородных атомов в молекулах альдегидов, кетонов, кислот и их производных. Иногда сверхсопряжение называют по имени открывших его ученых эффектом Натана—Беккер
rue. 2.iu. ^хема перекрывания а-ороиталеи связи ^—п с п-орОиталью кратноИ связи в молекуле пропена Величина эффекта гиперконъюгации тем выше, чем больше атомов водорода при углероде, связанном с ненасыщенной системой. Понятие о сверхсопряжении объясняет повышенную реакционную способность, подвижность а-водородных атомов в молекулах альдегидов, кетонов, кислот и их производных. Иногда сверхсопряжение называют по имени открывших его ученых эффектом Натана—Беккер
50.Структурная изомерия органических соединений.Виды структурной изомерии Изомеры – вещества, имеющие один и тот же состав, но разное строение, а, следовательно, и разные свойства. Отметить, что для органических соединений существуют следующие типы изомерии: I. Структурная изомерия, обусловленная различным взаимным расположением атомов в молекулах. При этом возможны следующие виды структурной изомерии: 1. Изометрия углеродного скелета. Обусловлена различным порядком соединения атомов углерода в цепи. Привести несколько примеров. Следует отметить, что атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя –четвертичным. 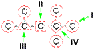 2. Изометрия положения кратных связей и функциональных групп. Обусловлена различным положением кратных связей или функциональных групп при одной и той же углеродной цепи. Привести примеры изомеров данного типа. 3. Изометрия порядка связанных атомов Этот тип изомерии характерен для соединений, содержащих в цепи помимо углеродных атомов другие атомы, например O, N.
2. Изометрия положения кратных связей и функциональных групп. Обусловлена различным положением кратных связей или функциональных групп при одной и той же углеродной цепи. Привести примеры изомеров данного типа. 3. Изометрия порядка связанных атомов Этот тип изомерии характерен для соединений, содержащих в цепи помимо углеродных атомов другие атомы, например O, N. 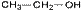
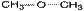
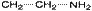
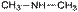 II. Пространственная изомерия (стереоизомерия). Этот тип изомерии обусловлен различным пространственным расположением атомов при одинаковом порядке их связывания. Возможны следующие виды пространственной изомерии: 1. Конформационная изомерия. Следует отметить, что атомы и группы атомов, связанные друг с другом σ-связью, постоянно вращаются относительно оси связи, занимая различное положение в пространстве друг относительно друга. Молекулы, имеющие одинаковое строение и различающиеся пространственным расположением атомов в результате вращения вокруг С–С связей, называются конформерами. Для изображения конформационных изомеров удобно пользоваться формулами – проекциями Ньюмена:
II. Пространственная изомерия (стереоизомерия). Этот тип изомерии обусловлен различным пространственным расположением атомов при одинаковом порядке их связывания. Возможны следующие виды пространственной изомерии: 1. Конформационная изомерия. Следует отметить, что атомы и группы атомов, связанные друг с другом σ-связью, постоянно вращаются относительно оси связи, занимая различное положение в пространстве друг относительно друга. Молекулы, имеющие одинаковое строение и различающиеся пространственным расположением атомов в результате вращения вокруг С–С связей, называются конформерами. Для изображения конформационных изомеров удобно пользоваться формулами – проекциями Ньюмена:
 |  |  |  |
| Заслоненный конформер | Заторможенный конформер |
Явление конформационной изомерии можно рассмотреть и на примере циклоалканов. Так, для циклогексана характерны конформеры:
 | 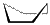 |
| кресло | ванна |
2. Геометрическая изометрия (цис-, транс- изомерия). Характерна для непредельных органических соединений, содержащих двойную связь. Так, например, молекула бутена-2 существует в виде двух геометрических изомеров:
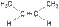 | 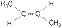 |
| цис-бутен-2 | транс-бутен-2 |
Следует отметить, что, кроме алкенов, геометрическая изомерия характерна для алициклических соединений и обусловлена различным взаимным положением заместителей относительно плоскости цикла. Так, например, 1,2-диметилциклопропан существует в виде цис- и транс- изомеров:
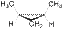 | 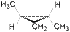 |
| цис-1,2-диметилциклопропан | транс-1,2-диметилциклопропан |
3. Оптическая изометрия Следует обратить внимание на существование органических соединений, имеющих одинаковый состав, одинаковое строение и свойства, но по-разному относящихся к плоскополяризованному свету. Так, при пропускании через такие соединения луча поляризованного света происходит отклонение плоскости поляризации на определенный угол. Соединения, которые вращают плоскость поляризации, называют оптически активными. Изомер, вращающий плоскость поляризации света против часовой стрелки, называют левовращающим [L(–)-форма], а по часовой стрелке – правовращающим [D(+)-форма]. Такие изомеры называются оптическими, или зеркальными изомерами (оптическими антиподами, энантиомерами). Оптическая изомерия обусловлена наличием асимметрического атома углерода С*, связанного с четырьмя различными заместителями. Привести примеры оптических изомеров. Так, например, оптические изомеры молочной кислоты отличаются друг от друга как предмет от своего зеркального изображения.
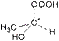 | 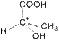 |
| D(+) молочная кислота | L(-) молочная кислота |
| (Тпл. = 26 0С, [α] = +3,8) | (Тпл. = 26 0С, [α] = -3,8) |
Молекулы, которые нельзя совместить в пространстве и которые относятся друг к другу как предмет к своему зеркальному изображению, называютхиральными (от греческого «хейрос» – рука), а явление существования таких веществ называется хиральностью. Смесь равных количеств L- и D-форм называется рацематической смесью. Рацематическая смесь оптически неактивна, т.к. действие одного антипода компенсируется действием другого.
51. стереоизомерия органических соединений. Виды пространственной изомерии Стереоизомерами(пространственные изомеры) называются соединения, имеющие одинаковый состав и строение, но различающиеся расположением атомов в пространстве. Со стереоизомерией, как правило, мы встречаемся в области природных соединений. Часто тонкие различия в пространственной структуре этих соединений обусловливает специфический характер их биологической активности. В основе стереоизомерии лежат понятия конформации и конфигурации молекул. Конфигурация – это порядок расположения атомов в пространстве без учета различий, возникающих вследствие вращения вокруг одинарной связи. В соответствии с этим конфигурационные изомеры представляют собой стереоизомеры с различным расположением атомов и групп в пространстве относительно друг друга. По критерию симметрии стереоизомеры поразделяют:  на энантиомеры - (стереоизомеры, являющиеся зеркальным отражением друг друга); диастереомеры - (стереоизомеры, не являющиеся зеркальным отражением друг друга). Согласно энергетическому критерию, стереоизомеры делят: на конфигурационные стереизомеры (взаимопревращение затруднено, энергетический барьер > 100 кДж/моль) конформационные стереизомеры (взаимопревращение осуществляется относительно легко, энергетический барьер < 60 кДж/моль) Пространственная изомерия 1.1. Геометрическая изомерия. Характерна для соединений, имеющих в составе молекулы двойную связь или цикл и около них одинаковые атомы или группы атомов. Примеры: 1) СН3–СН=СН–СН3 бутен-2. Для этого вещества характерны два геометрических изомера:
на энантиомеры - (стереоизомеры, являющиеся зеркальным отражением друг друга); диастереомеры - (стереоизомеры, не являющиеся зеркальным отражением друг друга). Согласно энергетическому критерию, стереоизомеры делят: на конфигурационные стереизомеры (взаимопревращение затруднено, энергетический барьер > 100 кДж/моль) конформационные стереизомеры (взаимопревращение осуществляется относительно легко, энергетический барьер < 60 кДж/моль) Пространственная изомерия 1.1. Геометрическая изомерия. Характерна для соединений, имеющих в составе молекулы двойную связь или цикл и около них одинаковые атомы или группы атомов. Примеры: 1) СН3–СН=СН–СН3 бутен-2. Для этого вещества характерны два геометрических изомера: 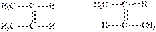 цис-бутен-2 транс-бутен-2 2) Для циклопропандикарбоновой кислоты также характерны два геометрических изомера:
цис-бутен-2 транс-бутен-2 2) Для циклопропандикарбоновой кислоты также характерны два геометрических изомера: 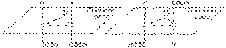 цис-циклопропандикарбоновая кислота транс-циклопропандикарбоновая кислота. Могут быть и другие виды пространственной изомерии, не рассматривающиеся в школьном курсе химии. III. Таутомерия – вид изомерии, при которой одно и то же вещество существует в виде нескольких форм, находящихся в состоянии динамического равновесия. Примеры:
цис-циклопропандикарбоновая кислота транс-циклопропандикарбоновая кислота. Могут быть и другие виды пространственной изомерии, не рассматривающиеся в школьном курсе химии. III. Таутомерия – вид изомерии, при которой одно и то же вещество существует в виде нескольких форм, находящихся в состоянии динамического равновесия. Примеры:
1). Кольчато-цепная таутомерия глюкозы:  a-глюкоза открытая, альдегидная форма глюкозы b-глюкоза 2). Кето-енольная таутомерия (енолы – это соединения, содержащие в молекулах гидроксильную группу и двойную связь):
a-глюкоза открытая, альдегидная форма глюкозы b-глюкоза 2). Кето-енольная таутомерия (енолы – это соединения, содержащие в молекулах гидроксильную группу и двойную связь): 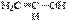 ⇄
⇄ 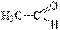 виниловый спирт (енольная форма) уксусный альдегид (кетоформа);
виниловый спирт (енольная форма) уксусный альдегид (кетоформа); 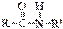 ⇄
⇄ 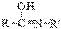 кетоформа пептидной связи енольная форма пептидной связи
кетоформа пептидной связи енольная форма пептидной связи
=========================================================================52). Классификация органический реакций. Понятие о механизме реакций. КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ В отличие от неорганических реакций, которые классифицируют по типу взаимодействия, изменению степени окисления, тепловому эффекту, обратимости и т. п., в органических реакциях в первую очередь учитывают механизм разрыва существующих химических связей и процессы, предшествующие образованию новых связей. По типу разрыва химической связи органические реакции можно разделить на две группы. Радикальные реакции, в которых происходит гомолитический разрыв общей электронной пары, образующей связь. При этом возникают свободные радикалы — частицы, обладающие неспаренным электроном Ионные реакции, в которых происходит гетеролитический разрыв связи. При этом оба электрона остаются у одной из образующихся частиц. Эта частица (нуклеофил), обладающая парой неподеленных электронов на внешнем уровне, заряжается отрицательно и в последующих процессах может стать донором электронов для вновь образующейся связи. Вторая частица (электрофил) несет на себе положительный заряд и имеет на внешнем уровне незаполненную свободную орбиталь. В последующих процессах ее можно предоставить электронодонору для образования общей связи, т. е. электрофил является акцептором электронов. Электрофилнуклеофил. Реагенты можно разделить на радикальные, электрофильные и нуклеофильные. Это деление связано с тем, что реагент может реагировать с различными частями молекулы объекта. 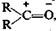
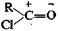 Электрофильным называется реагент,который взаимодействует с электронодонорной частью молекулы объекта, предоставляя ей свою вакантную орбиталь. Это положительно заряженные ионы (Н+, Н3O+ и др.) или молекулы, на части которых в результате поляри-зации образовался положительный заряд, например: Нуклеофильным называется реагент, который взаимодействует с электронодефицитной частью молекулы объекта, предоставляя ей свою неподеленную пару электронов. Нуклеофилы — это анионы и молекулы, несущие неподеленную электронную пару (НО-, RCOO-, Сl-, Вr- и т. п.). Объект не остается безразличным к воздействию реагента, из него возникают определенные промежуточные соединения, которые также могут иметь характер одного из трех вышеназванных состояний, т. е. быть свободным радикалом, катионом или анионом. С учетом описанных особенностей объекта и реагента, а также структурных изменений, происходящих в той или иной реакции, все органические реакции делят на: Реакции замещения: R—СН2—X + АВ —>R—СН2—А + ХВ. При этом они могут быть радикальными (SR), электрофильными (SE) или нуклеофильными (SN). Реакции присоединения, характерной особенностью которых является разрыв кратной связи: RCH=CH2 + АВ —> RCH—СН2. | | A B; Они тоже могут быть разделены на электрофильные (AdE), нуклеофильные (AdN) и даже радикальные (AdR). В использованных общепринятых обозначениях буква S является начальной из английского слова Substitution — замещение, а буквы Ad соответствуют слову Addition — присоединение, тогда как нижние индексы обозначают радикал, электрофил или нуклеофил соответственно. Реакции отщепления (элиминирования):
Электрофильным называется реагент,который взаимодействует с электронодонорной частью молекулы объекта, предоставляя ей свою вакантную орбиталь. Это положительно заряженные ионы (Н+, Н3O+ и др.) или молекулы, на части которых в результате поляри-зации образовался положительный заряд, например: Нуклеофильным называется реагент, который взаимодействует с электронодефицитной частью молекулы объекта, предоставляя ей свою неподеленную пару электронов. Нуклеофилы — это анионы и молекулы, несущие неподеленную электронную пару (НО-, RCOO-, Сl-, Вr- и т. п.). Объект не остается безразличным к воздействию реагента, из него возникают определенные промежуточные соединения, которые также могут иметь характер одного из трех вышеназванных состояний, т. е. быть свободным радикалом, катионом или анионом. С учетом описанных особенностей объекта и реагента, а также структурных изменений, происходящих в той или иной реакции, все органические реакции делят на: Реакции замещения: R—СН2—X + АВ —>R—СН2—А + ХВ. При этом они могут быть радикальными (SR), электрофильными (SE) или нуклеофильными (SN). Реакции присоединения, характерной особенностью которых является разрыв кратной связи: RCH=CH2 + АВ —> RCH—СН2. | | A B; Они тоже могут быть разделены на электрофильные (AdE), нуклеофильные (AdN) и даже радикальные (AdR). В использованных общепринятых обозначениях буква S является начальной из английского слова Substitution — замещение, а буквы Ad соответствуют слову Addition — присоединение, тогда как нижние индексы обозначают радикал, электрофил или нуклеофил соответственно. Реакции отщепления (элиминирования): 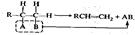 Кроме того, следует обратить внимание на реакции: Перегруппировки атомов (или групп атомов) внутри молекулы:
Кроме того, следует обратить внимание на реакции: Перегруппировки атомов (или групп атомов) внутри молекулы: 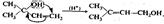 Окисления и восстановления:
Окисления и восстановления: 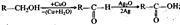 первичный спирт альдегид кислота
первичный спирт альдегид кислота 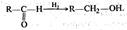 альдегид первичный спирт Этерификации (и обратной ей реакции гидролиза):
альдегид первичный спирт Этерификации (и обратной ей реакции гидролиза): 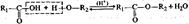 кислота спирт сложный эфир Полимеризации и поликонденсации:
кислота спирт сложный эфир Полимеризации и поликонденсации: 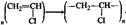 хлорвинил поливинилхлорид
хлорвинил поливинилхлорид
 2015-06-05
2015-06-05 1269
1269