Чтобы ответить на поставленный вопрос, необходимо иметь представление об электролитической диссоциации и гидролизе солей.
Электролиты – это вещества, которые распадаются в воде, в других полярных жидкостях или расплавах на частицы (ионы), способные проводить электрический ток. Распад вещества на ионы под действием молекул растворителя называется электролитической диссоциацией. Вещества, молекулы которых хорошо распадаются на ионы, называются сильными электролитами. К ним относятся кислоты: HCl, H2SO4, HNO3, НI; основания: NaOH, KOH, LiOH, CsOH, Са(OH)2, Ва(OH)2; все соли: CuSO4, Li2CO3, K2S, FrCl, CsNO3, MnCO3, MnS, AgBr, PbCO3, FeF2, CuS, BaCO3 и др.
Слабые электролиты – это вещества, молекулы которых не полностью распадаются на ионы, т.е. в растворе могут присутствовать как ионы, так и не распавшиеся молекулы. К ним относится вода Н2О, кислоты: H2S, HF, H2CO3, H3PO4, H2SO3,CH3COOH, HCN, H2SiO3, HSCN, H2CrO4; основания: NH4OH и практически все гидроксиды p - и d -металлов, например: Cu(OH)2, Al(OH)3, Fe(OH)2, Fe(OH)3, Pb(OH)2, Cr(OH)3 и др.
Гидролизом солей называют реакции обмена между водой и растворенными в ней солями, в результате которого катион или анион соли образует с составными частями молекулы воды новое прочное соединение а в растворе появляется некоторое избыточное количество ионов Н+ или ОН  , сообщающее раствору кислотные или щелочные свойства.
, сообщающее раствору кислотные или щелочные свойства.
Для оценки рН раствора соли при ее гидролизе можно воспользоваться схемой, в которой учитывается сила кислот и оснований, образующих данную соль. Сильный электролит определяет рН раствора.
Например:
| CuSO4 | Na2S | (NH4)2S | KCl | ||||
| Cu(OH)2 | H2SO4 | NaOH | H2S | NH4OH | H2S | KOH | HCl |
| слабый | сильный | сильный | слабый | слабый | слабый | сильный | сильный |
| pH < 7 | pH > 7 | pH ≈ 7 | гидролизу не подвергается |
Рассмотрим гидролиз солей, приведенных в задании.
а) Соль, образованная слабым основанием и сильной кислотой – Zn(NO3)2.
При написании реакции взаимодействия соли с водой проставляем степени окисления элементов, проводим обмен между ионами соли и воды, при необходимости уравниваем стехиометрические коэффициенты и получаем уравнение реакции гидролиза в молекулярном виде:
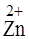
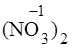 + 2H+OH
+ 2H+OH  = Zn(OH)2 + 2 HNO3.
= Zn(OH)2 + 2 HNO3.
Далее записываем уравнение реакции гидролиза в ионно-молекулярном виде. Для этого сначала, пользуясь приведенным выше перечнем электролитов, подчеркиваем слабые электролиты:
Zn(NO3)2 + 2HOH = Zn(OH)2 + 2HNO3.
Молекулы слабых электролитов оставляем без изменения, а остальные молекулы запишем в ионном виде:
Zn2+ + 2(NO3)  + 2HOH = Zn(OH)2 + 2H+ + 2(NO3)
+ 2HOH = Zn(OH)2 + 2H+ + 2(NO3)  .
.
Проводим сокращение и приводим уравнение реакции:
Zn2+ + 2НОН = Zn(OH)2 + 2H+.
Таким образом, между солью и водой происходит взаимодействие, образуется прочное соединение Zn(OH)2 и появляется избыток ионов Н+, что характеризует кислую среду, рН которой < 7.
Следует, однако, иметь в виду, что полученное уравнение реакции гидролиза дается в упрощенном виде и не дает полного ответа об истинном составе всех получающихся продуктов. Так, при гидролизе солей многозарядных катионов и анионов процесс идет по ступеням и, как правило, заканчивается на I ступени. Например, гидролиз рассматриваемой соли Zn(NO3)2 по первой ступени выражается следующими уравнениями.
В молекулярном виде:
Zn(NO3)2 + HOH = Zn(OH)NO3 + HNO3;
в ионно-молекулярном виде:
Zn2+ + 2(NO3)  + HOH = Zn(OH)+ + 2(NO3)
+ HOH = Zn(OH)+ + 2(NO3)  + H+;
+ H+;
в сокращенном виде:
Zn2+ + HOH = Zn(OH)+ + H+ – сокращенный вид.
В данном случае в процессе гидролиза образуется основная соль Zn(OH)NO3.
б) Соль образована сильным основанием и слабой кислотой – Li2CO3.
В молекулярном виде:
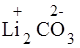 + 2Н+ОН
+ 2Н+ОН  = 2LiOH + H2CO3;в
= 2LiOH + H2CO3;в
в ионно-молекулярном виде:
2Li+ + CO 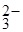 + 2HOH = 2Li2+ + 2OH
+ 2HOH = 2Li2+ + 2OH  + H2CO3;
+ H2CO3;
в сокращенном виде:
CO 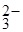 + 2НОН = 2ОН
+ 2НОН = 2ОН  + Н2СО3.
+ Н2СО3.
Так как в результате реакции гидролиза появляется избыток ионов ОН  , то среда щелочная и рН > 7.
, то среда щелочная и рН > 7.
Гидролиз по первой ступени выражается следующими уравнениями.
В молекулярном виде:
Li2CO3 + НОН = LiНСО3 + LiOH;
в ионно-молекулярном виде:
2Li+ + CO 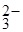 + HOH = 2Li+ + (HCO3)
+ HOH = 2Li+ + (HCO3)  + OH
+ OH  ;
;
в сокращенном виде:
CO 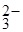 + НОН = (HCO3)
+ НОН = (HCO3)  + OH
+ OH  .
.
В результате гидролиза образуется кислая соль LiHCO3 – бикарбонат лития.
в) Соль образована слабым основанием и слабой кислотой – CuS.
В молекулярном виде:
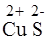 + 2Н+ОН
+ 2Н+ОН  = Cu(OH) 2 + H2S;
= Cu(OH) 2 + H2S;
в ионно-молекулярном виде:
Cu2+ + S 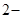 + 2HOH = Cu(OH)2 + H2S.
+ 2HOH = Cu(OH)2 + H2S.
В результате реакции гидролиза образовались прочные соединения Cu(OH)2 и H2S, т.е. происходит необратимый гидролиз соли. А так как в правой части отсутствует избыток ионов Н+ или ОН  , то рН раствора не меняется, среда нейтральная (рН ≈ 7). Незначительные отклонения рН от 7 в ту или иную сторону зависят от степени диссоциации Cu(OH)2 и H2S.
, то рН раствора не меняется, среда нейтральная (рН ≈ 7). Незначительные отклонения рН от 7 в ту или иную сторону зависят от степени диссоциации Cu(OH)2 и H2S.
г) Соль образована сильным основанием и сильной кислотой – RbNO3.
В молекулярном виде:
Rb+NO3– + Н+ОН  = RbOH + HNO3;
= RbOH + HNO3;
в ионно-молекулярном виде:
Rb+ + NO 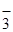 + HOH = Rb+ + OH
+ HOH = Rb+ + OH  + H+ + NO
+ H+ + NO 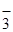 ;
;
в сокращенном виде:
НОН = Н+ + ОН  .
.
Таким образом, по сокращенному виду, отражающему суть реакции, очевидно, что в данном случае процесс связан с диссоциацией молекул воды, а молекулы соли в реакции не участвуют. То есть соль, образованная сильным основанием и сильной кислотой, гидролизу не подвергается. Так как в правой части реакции присутствуют ионы Н+ и ОН  , то среда будет нейтральная и рН = 7.
, то среда будет нейтральная и рН = 7.
Задание 5.4. Смешивают равные объемы двух солей. Молярные концентрации солей равны. Используя табличное значение произведения растворимости (ПР), определите образуется ли осадок труднорастворимой соли (табл. V.4).
 2015-06-05
2015-06-05 2632
2632








