Для ответа на поставленный вопрос необходимо иметь представление о произведении растворимости (ПР). Это понятие используется только для труднорастворимых в воде веществ, являющихся, однако, сильными электролитами. Для таких веществ при постоянной температуре произведение равновесных концентраций ионов, входящих в состав соединения (взятых в степенях, равных количеству ионов в формуле соли) всегда остается величиной постоянной и зависит только от природы соли. Например, для насыщенного раствора труднорастворимого вещества A n B m, находящегося в равновесии с его твердой фазой будет характерен следующий обратимый процесс:
 |
 |
Этот процесс является гетерогенным, поэтому константа равновесия процесса будет определяться только произведением концентраций ионов в растворе и не зависит от концентрации твердого компонента.
Кравн = [A m +] n ·[B 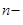 ] m = ПР
] m = ПР 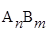 .
.
Значения ПР труднорастворимых электролитов приводятся в справочной литературе. Если произведение реальных концентраций превышает произведение равновесных концентраций, т.е. больше ПР, то образуется осадок, а при условии, что это произведение меньше значения ПР – осадок не образуется.
Для примера возьмем соли CaF2 и K3PO4. Молярные концентрации их равны 0,002 моль/л.
Приведем уравнение реакции образования труднорастворимой соли:
3СаF2 + 2K3PO4 = Ca3(PO4)2↓ + 6KF – молекулярный вид,
3Са2+ + 3РО 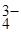 = Са3(РО4)2↓ – ионно-молекулярный вид.
= Са3(РО4)2↓ – ионно-молекулярный вид.
При решении следует учесть, что при смешивании равных объемов двух солей суммарный объем раствора возрастает в 2 раза, а концентрация каждой соли уменьшается в 2 раза. Следовательно: с (CaF2) = 0,001 моль/л; с (К3РО4) = 0,001 моль/л.
Так как нас интересует образование осадка Ca3(PO4)2, то необходимо использовать концентрации ионов Са2+ и (РО4)3-, которые совпадают с молярной концентрацией солей при условии, что степень диссоциации равна единице.
Рассчитываем произведение концентраций указанных ионов с учетом их количества в формуле предполагаемого осадка Ca3(PO4)2:
с 3 (Са2+) × с 2 (РО 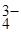 ) = (0,001)3 × (0,001)2 = 10-15.
) = (0,001)3 × (0,001)2 = 10-15.
Сравниваем со значением ПР (Ca3(PO4)2): так как 10-15 > 2,0·10-29, значит осадок образуется.
Таблица V.1
| Номер варианта | Соль | V, л | Массовая доля, % | ρ, кг/м3 |
| AlCl3 | 0,5 | |||
| AgNO3 | 1,5 | |||
| AgNO3 | 0,8 | |||
| Al2(SO4)3 | 0,8 | |||
| Al2(SO4)3 | 1,5 | |||
| BaCl2 | 3,0 | |||
| BaCl2 | 0,3 | |||
| CaCl2 | 0,5 | |||
| CaCl2 | 0,9 | |||
| CuSO4 | 2,5 | |||
| CuSO4 | 9,65 | |||
| FeCl3 | 0,9 | |||
| FeCl3 | 1,7 | |||
| FeSO4 | 1,5 | |||
| FeSO4 | 3,5 | |||
| K2CO3 | 2,0 | |||
| K2CO3 | 0,6 | |||
| K2Cr2O7 | 2,5 | |||
| K2Cr2O7 | 0,4 | |||
| K2SO4 | 3,0 | |||
| K2SO4 | 1,2 | |||
| MgSO4 | 4,0 | |||
| MgSO4 | 1,6 | |||
| Na2CO3 | 0,5 | |||
| Na2CO3 | 3,5 | |||
| AlCl3 | 6,5 | |||
| BaCl2 | 4,0 | |||
| BaCl2 | 3,5 | |||
| K2SO4 | 2,0 | |||
| K2SO4 | 5,0 |
Таблица V.2
| Номер варианта | Основание или кислота | Концентрация, с, моль/л |
| КОН | 0,01 | |
| KOH | 0,001 | |
| KOH | 0,1 | |
| KOH | 1·10-4 | |
| KOH | 1·10-5 | |
| NaOH | 0,01 | |
| NaOH | 0,001 | |
| NaOH | 0,1 | |
| NaOH | 1·10-4 | |
| NaOH | 1·10-5 | |
| LiOH | 0,01 | |
| LiOH | 0,001 | |
| HNO3 | 0,01 | |
| HNO3 | 0,001 | |
| HNO3 | 0,1 | |
| HNO3 | 1·10-4 | |
| HNO3 | 1·10-5 | |
| HCl | 0,01 | |
| HCl | 0,001 | |
| HCl | 1·10-4 | |
| HCl | 1·10-5 | |
| HCl | 0,1 | |
| HI | 0,01 | |
| HI | 1·10-3 | |
| HI | 1·10-4 | |
| HI | 0,01 | |
| HI | 1·10-3 | |
| HI | 1·10-4 | |
| HI | 0,1 | |
| HI | 0,01 |
Таблица V.3
| Номер варианта | Формулы солей | |||
| AlCl3 | Na2CO3 | Al2(CO3)3 | NaCl | |
| Al2(SO4)3 | K2CO3 | AgBr | Na2SO4 | |
| Al(NO3)3 | Li2CO3 | Ag2CO3 | NaNO3 | |
| ZnCl2 | Rb2CO3 | AgCl | KCl | |
| FeCl3 | Cs2CO3 | CH3COOAg | K2SO4 | |
| ZnI2 | Li2SiO3 | Ag3PO4 | KNO3 | |
| Zn(NO3)2 | K2SiO3 | Ag2S | Li2SO4 | |
| ZnSO4 | Na2SiO3 | Ag2SO4 | LiCl | |
| CuCl2 | K2S | BaCO3 | LiNO3 | |
| CuI2 | Na2S | BaSO3 | Rb2SO4 | |
| Cu(NO3)2 | K2SO3 | BaCrO4 | RbCl | |
| CuSO4 | Na2SO3 | CaCO3 | RbNO3 | |
| MnCl2 | K3PO4 | Ca3(PO4)2 | CsCl | |
| MnI2 | Na3PO4 | Al2S3 | Cs2SO4 | |
| Mn(NO3)2 | Li2S | CdCO3 | CsNO3 | |
| MnSO4 | K2S | CuCO3 | FrCl | |
| FeCl2 | Na2SiO3 | CuS | Fr2SO4 | |
| Li(NO3)2 | Li2CO3 | FeS | FrNO3 | |
| FeI2 | Li2SiO3 | MgS | NaF | |
| Fe(NO3)2 | Li2SO3 | MnCO3 | KF | |
| FeSO4 | Cs2CO3 | MnS | LiF | |
| SnCl2 | K2S | PbCO3 | CsF | |
| CuF2 | K2HPO4 | PbBr2 | LiI | |
| FeF2 | NaHCO3 | MnBr2 | NaI | |
| AlF3 | NaHSiO3 | CaSO3 | CsI | |
| NH4Cl | NaNO2 | AlPO4 | KI | |
| NH4NO3 | CH3COONa | (NH4)2S | Rb2SO4 | |
| Fe2(SO4)3 | Ba(CH3COO)2 | (NH4)3PO4 | LiCl | |
| CoCl2 | KH2PO4 | (NH4)2CO3 | CsNO3 | |
| NiCl2 | NaHSO3 | CH3COONH4 | FrCl |
Таблица V.4
| Вариант | Соль I | Соль II | cМ, моль/л | Труднораство-римое соединение | ПР трудно-растворимого соединения при 25 0С |
| SrCl2 | K2SO4 | 0,002 | SrSO4 | 2,8·10-7 | |
| AgNO3 | NaBr | 0,001 | AgBr | 6,3·10-13 | |
| AgNO3 | K2CO3 | 0,001 | Ag2CO3 | 6,25·10-12 | |
| AgNO3 | KCl | 0,002 | AgCl | 1,56·10-10 | |
| AgNO3 | KI | 0,001 | AgI | 1,5·10-16 | |
| AgNO3 | Na3PO4 | 0,001 | Ag3PO4 | 1,8·10-18 | |
| AgNO3 | Na2S | 0,0001 | Ag2S | 5,7·10-51 | |
| AgNO3 | K2SO4 | 0,002 | Ag2SO4 | 7,7·10-5 | |
| BaCl2 | Na2SO3 | 0,001 | BaCO3 | 7,0·10-9 | |
| Ba(NO3)2 | Na2CrO4 | 0,002 | BaCrO4 | 2,3·10-10 | |
| BaCl2 | K2SO4 | 0,002 | BaSO4 | 1,08·10-10 | |
| CaCl2 | K2CO3 | 0,001 | CaCO3 | 4,8·10-9 | |
| Ca(NO3)2 | Na3PO4 | 0,002 | Ca3(PO4)2 | 1,0·10-25 | |
| CaCl2 | Na2SO4 | 0,001 | CaSO4 | 6,1·10-5 | |
| Cd(NO3)2 | Na2CO3 | 0,001 | CdCO3 | 2,5·10-14 | |
| CuCl2 | Na2CO3 | 0,002 | CuCO3 | 2,36·10-10 | |
| Pb(NO3)2 | NaCl | 0,002 | PbCl2 | 1,7·10-5 | |
| Pb(NO3)2 | K2CO3 | 0,001 | PbCO3 | 1,5·10-13 | |
| MgCl2 | K2S | 0,001 | MgS | 2,0·10-15 | |
| Ni(NO3)2 | K2S | 0,001 | NiS | 3,2·10-19 | |
| Pb(NO3)2 | NaBr | 0,001 | PbBr2 | 9,1·10-6 | |
| SrCl2 | Na2CO3 | 0,002 | SrCO3 | 9,42·10-10 | |
| ZnCl2 | K2CO3 | 0,001 | ZnCO3 | 6,0·10-11 | |
| Zn(NO3)2 | K2S | 0,001 | ZnS | 1,6·10-24 | |
| Sr(NO3)2 | NaF | 0,001 | SrF2 | 2,5·10-9 | |
| AlCl3 | NaOH | 0,002 | Al(OH)3 | 1,0·10-32 | |
| AgNO3 | K2CrO4 | 0,001 | Ag2CrO4 | 1,1·10-12 | |
| AgNO3 | K2Cr2O7 | 0,001 | Ag2Cr2O7 | 1,0·10-10 | |
| BaCl2 | NaF | 0,001 | BaF2 | 1,1·10-6 | |
| Ba(NO3)2 | NaOH | 0,002 | Ba(OH)2 | 5,0·10-3 |
Тема VI. ОСНОВЫ ЭЛЕКТРОХИМИИ
Задание 6.1. В данной окислительно-восстановительной реакции (табл. VI.1) определите стехиометрические коэффициенты ионно-электронным методом и рассчитайте термодинамическую вероятность протекания реакции.
 2015-06-05
2015-06-05 694
694








