Согласно своему варианту выбираем химическую реакцию с указанием величины изменения энтальпии (Δ Н) химической реакции. Рассмотрим две реакции:
а) 4NH3 (г) + 3О2 (г) 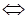 2N2 (г) + 6Н2О (г) Δ Н0х.р. < 0;
2N2 (г) + 6Н2О (г) Δ Н0х.р. < 0;
б) 2SO2 (г) + 2PbO (тв) 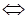 2PbS (тв) + 3О2 (г) Δ Н0х.р. > 0.
2PbS (тв) + 3О2 (г) Δ Н0х.р. > 0.
4.1.1. Реакции бывают гомогенные и гетерогенные.
Гомогенные реакции протекают в однородной среде (одной фазе) и, как правило, в реакции участвуют жидкие или газообразные вещества.
Гетерогенные реакции протекают на границе раздела фаз, чаще всего на поверхности твердого тела.
Исходя из того, что исходными веществами в реакции а) являются газообразные вещества NH3 и О2 – данная реакция при протекании в прямом направлении является гомогенной. Если реакция протекает в обратном направлении, то взаимодействуют газообразные вещества N2 и Н2О, и данная реакция также является гомогенной.
В реакции б) в прямом направлении химическое взаимодействие идет на поверхности PbO (тв), поэтому данная реакция является гетерогенной. По аналогии, если рассмотреть реакцию б) в обратном направлении, то взаимодействие О2 (г) с PbS (тв) происходит на поверхности твердой фазы – данная реакция также является гетерогенной.
4.1.2. Из закона действующих масс известно, что при постоянной температуре скорость химической реакции (V) зависит от природы вещества, выражаемой через константу скорости (k), и концентрации реагирующих веществ, возведенные в степень, равную числу молей веществ в уравнении химической реакции ([A]a).
Для газообразных веществ вместо концентраций можно использовать парциальные давления газов (Р 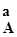 ).
).
Если вещества твердые, то их концентрация остается постоянной и принимается равной единице. В кинетическом уравнении концентрация твердых веществ не учитывается.
Таким образом, для первой реакции а), которая является гомогенной, закон действующих масс выражается следующими уравнениями:
для прямого направления
V пр. = k пр. [NH3]4·[O2]3,
если концентрации веществ выразить через парциальные давления, то
V пр. = k пр.·Р 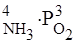 ;
;
для обратного направления
V обр. = k обр. [N2]2·[H2O]6, или
V обр. = k обр.Р 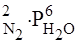 .
.
Для реакции б), которая является гетерогенной, концентрации твердых веществ не учитываем и получаем:
V пр. = k пр.[SO2]2, или V пр. = k пр.Р 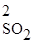 ;
;
V пр. = k пр.[O2]3, или V обр. = k обр.Р 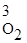 .
.
4.1.3. Число молекул реагентов, принимающих участие в простейшей (элементарной) стадии, называется ее молекулярностью (М). Элементарный акт представлен уравнением химической реакции.
Для варианта а) Мпр. = 4 + 3 = 7; Мобр. = 2 + 6 = 8.
Для варианта б) Мпр. = 2 + 2 = 4; Мобр. = 2 + 3 = 5.
Следует отметить, что молекулярность реакции не может быть выше 3, так как процесс идет сложным образом и протекает через ряд промежуточных стадий.
Порядок реакции показывает, как природа вещества влияет на зависимость скорости реакции от концентрации (или парциального давления) реагирующих веществ.
Порядок реакции (П) определяется суммой величин показателей степеней при значениях концентрации (парциального давления) реагирующих веществ. Порядок рассчитывается с использованием закона действующих масс. Тогда для вариантов:
а) Ппр.= 4 + 3 = 7; Побр. = 2 + 6 = 8;
б) Ппр. = 2; Побр. = 3.
4.1.4. Для реакции, которая находится в состоянии равновесия, скорости прямой и обратной реакции равны: V пр. = V обр..
Химическое равновесие выражается константой равновесия (Кравн.), которая характеризует отношение скоростей прямой и обратной реакций:
К равн. = 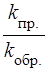 .
.
Константу равновесия следует выражать через отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции а):
К равн. = 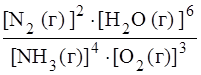 .
.
Так как все вещества находятся в газообразном состоянии, то константу равновесия можно выразить через парциальные давления:
К равн. = 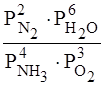 .
.
Для реакции б):
Так как PbS и PbO являются твердыми веществами, их концентрации принимаются равными единице и в выражении К равн. не учитываются. Поэтому
К равн. = 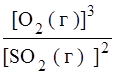 ,
,
или
К равн. = 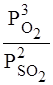 .
.
4.1.5. Согласно принципу Ле-Шателье, если на систему, находящуюся в равновесии, оказывать внешнее воздействие (изменение температуры, давления или концентрации), то равновесие смещается в том направлении, которое ослабляет внешнее воздействие.
А) При повышении концентрации исходных веществ равновесие сдвигается в сторону прямой реакции, т.е. вправо. Повышение концентрации продуктов реакции смещает равновесие в сторону обратной реакции, т.е. влево.
Рассмотрим, в какую сторону смещается равновесие при увеличении концентрации или парциальных давлений исходных веществ в 2 раза.
Если в законе действующих масс для прямой реакции (п. 4.1.2) парциальное давление каждого вещества увеличить в 2 раза, то получаем, что
для реакции а) V пр возрастает в 24·23 = 27 раз;
для реакции б) V обр возрастает в 22 раз.
Скорость обратной реакции не зависит от концентрации исходных веществ и остается постоянной. Поэтому в обоих случаях равновесие смещается в сторону продуктов реакции.
Б) Если увеличить объем всей системы в 3 раза, то концентрация (или парциальное давление) каждого вещества уменьшится в 3 раза. В результате уменьшится скорость как прямой, так и обратной реакции.
Для варианта а) V пр уменьшится в 34·33 = 37, а
V обр уменьшится в 32·36 = 38 раз.
Таким образом, больше окажется скорость прямой реакции, и равновесие сдвигается вправо.
Для варианта б) V пр уменьшится в 32 = 9 раз, а
V обр снизится в 33 = 27 раз.
Таким образом, равновесие реакции смещается вправо.
В) Рассмотрим сдвиг равновесия при повышении температуры.
Повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение температуры – в сторону экзотермической.
В случае а) Δ Н0х.р. < 0, энтальпия системы уменьшается. Следовательно прямая реакция сопровождается выделением тепла и является экзотермической. Тогда обратная реакция будет эндотермической, т.е. сопровождается поглощением тепла. При нагревании ускоряется реакция, идущая с поглощением тепла, т.е. обратная. Равновесие смещается влево.
В случае б) Δ Н0х.р. > 0. Прямая реакция протекает с поглощением тепла и является эндотермической, а обратная – экзотермической. Нагревание способствует ускорению прямой реакции, и равновесие сдвигается вправо.
Таблица IV.1
| Номер варианта | Уравнение реакции | Δ H 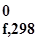 , кДж/моль , кДж/моль |
2NO (г) + O2  2NO2 (г) 2NO2 (г) | +116,9 | |
N2 (г) + 3H2 (г)  2NH3 (г) 2NH3 (г) | -91,9 | |
Н2 (г) + 1/2 О2 (г)  Н2О (ж) Н2О (ж) | -285,8 | |
2Al (т) + 3/2 O2 (г)  Al2O3 (т) Al2O3 (т) | -1675,8 | |
| 1/2Н2 (г) + 1/2 N2 (г) + 3/2 О2 (г) = НNО3 (ж) | -173,8 | |
SO2 (г) + 1/2 O2 (г)  SO3 (г) SO3 (г) | +98,0 | |
СН4 (г) + 2О2 (г)  СО2 (г) + 2Н2О (г) СО2 (г) + 2Н2О (г) | -802,3 | |
СН4 (г) + 2Н2О (г)  СО2 (г) + 4Н2 (г) СО2 (г) + 4Н2 (г) | +164,9 | |
1/2Н2 (г) + 1/2 Br2 (г)  НBr (г) НBr (г) | -35,9 | |
С3Н8 (г) + 5О2 (г)  3СО2 (г) + 4Н2О (г) 3СО2 (г) + 4Н2О (г) | -2043,8 | |
С6Н12О6 (г) + 6О2 (г)  6СО2 (г) + 6Н2О (ж) 6СО2 (г) + 6Н2О (ж) | -2816 | |
СН3ОН (ж)  СО (г) + 2Н2 (г) СО (г) + 2Н2 (г) | +128,1 | |
PCl5 (г)  PCl3 (г) + Cl2 (г) PCl3 (г) + Cl2 (г) | +129,6 | |
Н2 (г) + S (т)  Н2 (г) Н2 (г) | -41,8 | |
2HBr (г)  H2 (г) + Br2 (г) H2 (г) + Br2 (г) | -70,2 | |
Н2 (г) + S (ж)  Н2S (г) Н2S (г) | -20,9 | |
Fe2O3 (т) + 3H2 (г)  2Fe (т) + 3H2O (г) 2Fe (т) + 3H2O (г) | +89,6 | |
СаО (т) + СО2 (г)  СаСО3 (т) СаСО3 (т) | -178,0 | |
СО2 (г) + С (т)  2СО (г) 2СО (г) | +160,1 | |
MgCO3 (т)  MgO (т) + CO2 (г) MgO (т) + CO2 (г) | +117,4 | |
2СО (г) + О2 (г)  2СО2 (г) 2СО2 (г) | -568,5 | |
N2O4 (г)  2NO2 (г) 2NO2 (г) | +58,0 | |
СО (г) + Н2О (г)  СО2 (г) + Н2 (г) СО2 (г) + Н2 (г) | -41,8 | |
С (т) + Н2О (г)  СО (г) + Н2 (г) СО (г) + Н2 (г) | +117,0 | |
N2 (г) + O2 (г)  2NO (г) 2NO (г) | + 180,6 | |
4HCl (г) + О2 (г)  2Cl2 (г) + 2Н2О (г) 2Cl2 (г) + 2Н2О (г) | -116,4 | |
2С (т) + 3Н2 (г) + 1/2О2 (г)  С2Н5ОН (ж) С2Н5ОН (ж) | -277,6 | |
CS2 (ж) + 3О2 (г)  СО2 (г) + 2SO2 (г) СО2 (г) + 2SO2 (г) | -1075,0 | |
SO2 (г) + 2Н2S (г)  3S (т) + 2Н2О (ж) 3S (т) + 2Н2О (ж) | -234,5 | |
2ZnS (т) + 3О2 (г)  2ZnO (т) + 2SO2 (г) 2ZnO (т) + 2SO2 (г) | -890,0 |
Тема V. ДИСПЕРСНЫЕ СИСТЕМЫ
Задание 5.1. В определенном объеме раствора V л содержится m г вещества. Плотность раствора ρ (табл. V.1). Рассчитайте:
5.1.1. П роцентную концентрацию ( %, масс. ).
5.1.2. М олярность.
5.1.3. Н ормальность.
5.1.4. М оляльность раствора.
 2015-06-05
2015-06-05 1626
1626








