Гальванический элемент состоит из двух электродов и ионного проводника между ними. В качестве электродов используются металлы, уголь и другие вещества, обладающие электронной проводимостью (проводники I рода). Ионным проводником (проводником II рода) служат растворы или расплавы электролитов. Для обеспечения работы гальванического элемента, электроды соединяют друг с другом металлическим проводником, называемым внешней цепью. В качестве ионного проводника используется «соляный мостик», заполненный, например, насыщенным раствором KCl.
6.2.1. Рассмотрим гальванический элемент, состоящий из двух металлов, например, Al и Ni, погруженные в растворы собственных солей. Заданный гальванический элемент может быть представлен схемой:
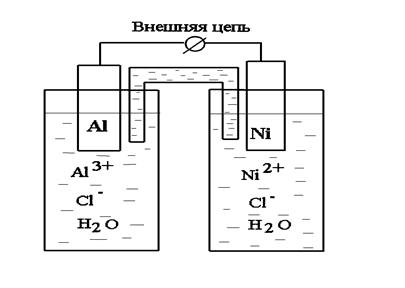 |
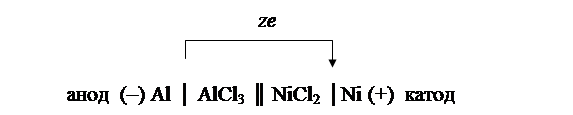 Схема гальванического элемента также может быть записана в виде:
Схема гальванического элемента также может быть записана в виде:
Одинарной вертикальной чертой показана граница между металлом и электролитом, а двойной – граница между электролитами.
Пользуясь данными Приложения 3, выписываем значения стандартных электродных потенциалов для каждого электрода:
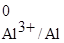 = –1,66 В;
= –1,66 В; 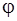
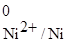 = –0,25 В.
= –0,25 В.
Сопоставление значений электродных потенциалов показывает, что большее количество электронов находится на поверхности алюминиевого электрода, поэтому на схеме гальванического элемента слева ставим знак (–), а никелевый электрод по сравнению с алюминиевым является более положительным, поэтому справа ставим знак (+). При замыкании внешней цепи электроны начинают переходить от алюминиевого электрода к никелевому, что на схеме указывается в виде стрелки сверху.
6.2.2. Учитывая, что электроны по внешней цепи движутся от восстановителя к окислителю и процесс отдачи электронов приводит к окислению, а приём электронов – к восстановлению, записываем реакции на электродах:
(–) анод: Al0 - 3 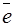 → Al3+ (окисление);
→ Al3+ (окисление);
(+) катод: Ni2+ + 2 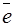 → Ni0 (восстановление).
→ Ni0 (восстановление).
Данные реакции протекают во внутренней цепи гальванического элемента.
Далее проводим расчет электродных потенциалов с учетом заданных концентраций растворов, например 0,001 моль/л.
Для этого используем уравнение Нернста для металлического электрода:
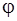
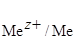 =
= 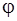
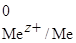 +
+ 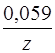 lg [Me z+ ],
lg [Me z+ ],
где 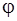
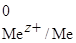 – стандартный электродный потенциал,
– стандартный электродный потенциал,
z – количество электронов, участвующих в элементарном акте окисления или восстановления;
[Me z+ ] – концентрация ионов металла в растворе.
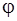
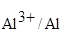 = -1,66 +
= -1,66 + 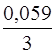 lg (0,001) = -1,66 +
lg (0,001) = -1,66 + 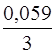 (-3) = -1,72 В.
(-3) = -1,72 В.
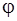
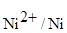 = -0,25 +
= -0,25 + 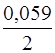 lg (0,001) = -0,25 +
lg (0,001) = -0,25 + 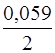 (-3) = -0,34 В.
(-3) = -0,34 В.
6.2.3. Проводим расчет ЭДС (ε) гальванического элемента и Δ G 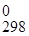 протекающей в нем реакции, помня, что z берется с учетом электронного баланса:
протекающей в нем реакции, помня, что z берется с учетом электронного баланса:
ε = φок. - φвосст. = -0,34 - (-1,72) = 1,38 В.
Δ G 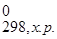 = - zF ε = -6×96500×1,38×10-3 = -799 кДж.
= - zF ε = -6×96500×1,38×10-3 = -799 кДж.
Так как значение Δ G 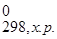 < 0, то процесс в данном гальваническом элементе термодинамически вероятен.
< 0, то процесс в данном гальваническом элементе термодинамически вероятен.
Задание 6.3. Составьте схемы электролиза и рассчитайте массу металла, выделяющегося на катоде по приведенным данным (табл. VI.3) при 3-х разных условиях его проведения:
6.3.1. Из раствора соли металла, при использовании растворимого анода.
6.3.2. Из раствора соли металла, при использовании нерастворимого анода.
6.3.3. Из расплава соли металла, при использовании растворимого анода.
 2015-06-05
2015-06-05 1505
1505








