1. Оксидоредуктазы, катализирующие окислительно-восстанови-
тельные реакции: аэробные и анаэробные дегидрогеназы, цитохромы, каталаза и пероксидаза;
2. Трансферазы, катализирующие реакции межмолекулярного переноса
различных химических групп и остатков: метил- и формилтрансферазы, ацетилтрансферазы, амино-, фосфотрансферазы.
3. Гидролазы, катализирующие реакции гидролиза внутри-
молекулярных связей:эстеразы, гликозидазы, фосфатазы и пептидогидролазы.
4. Лиазы (синтазы), катализирующие расщепление или образование
связи без участия окисления или гидролиза: фумарат-гидратаза, карбокси-лиазы, амидин-лиазы.
5. Изомеразы, катализирующие реакции изомеризации:рацемазы,эпимеразывнутримол-ные оксидоредуктазы и трансеразы.
6. Лигазы (синтетазы), катализирующие реакции присоединения,
сопряженные с разрывом макроэргической связи в АТФ или ГТФ, ЦТФ, УТФ,
ТТФ:L-глутамат, аммиак лигаза.
Амилаза и сахараза – класс гидролаз,
2)ФАДН2:
FAD — флавинадениндинуклеотид — кофермент, принимающий участие во многих окислительно-восстановительных биохимических процессах. FAD существует в двух формах — окисленной и восстановленной, его биохимическая функция, как правило, заключается в переходе между этими формами. FAD может быть восстановлен до FADH2, при этом он принимает два атома водорода. Молекула FADH2 является переносчиком энергии и восстановленный кофермент может быть использован как субстрат в реакции окислительного фосфорилирования в митохондрии.
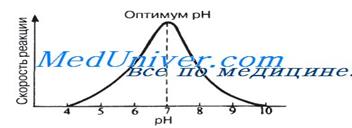
3) График зависимости скорости от рН:
При постоянной температуре любой фермент, как правило, работает наиболее эффективно в узких пределах рН. Оптимальным считается то значение рН, при котором реакция протекает с максимальной скоростью.
При более высоких и более низких рН активность фермента снижается. С понижением рН возрастает кислотность и увеличивается концентрация Н+-ионов.
Увеличивается, следовательно, количество положительных зарядов в среде. Сдвиг рН меняет заряд ионизированных кислотных и основных групп, что ведет к разрушению ионных связей, участвующих в поддержании специфичной формы молекул фермента. В результате изменяется форма молекул фермента и в первую очередь форма его активного центра. При слишком резких сдвигах рН фермент денатурирует.

4)Метод определения активности альфа-амилазы по Вольгемуту:
Вольгемута метод — определение активности амилазы (диастазы) в биологических жидкостях (слюне, моче, крови и др.). Активность фермента измеряется амилазными единицами, т. е. числом миллилитров 0,1% раствора крахмала, расщепленного в течение 30 мин. при t° 45 9 1 мл исследуемого раствора. Например, в норме активность амилазы в моче равна 16—64. Повышенные значения наблюдаются при панкреатите, заболеваниях желчных путей и др., пониженные значения вплоть до нуля — при почечной недостаточности.
5)Аденозинтрифосфа́т — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах. АТФ был открыт в 1929 году Карлом Ломанном[1], а в 1941 году Фриц Липман показал, что АТФ является основным переносчиком энергии в клетке.
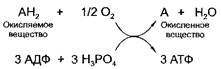
Аэробный путь ресинтеза АТФ - это основной, базовый способ образования АТФ, протекающий в митохондриях мышечных клеток. В ходе тканевого дыхания от окисляемого вещества отнимаются два атома водорода и по дыхательной цепи передаются на молекулярный кислород - 02, доставляемый кровью в мышцы из воздуха, в результате чего возникает вода. За счет энергии, выделяющейся при образовании воды, происходит синтез АТФ из АДФ и фосфорной кислоты. Обычно на каждую образовавшуюся молекулу воды приходится синтез трех молекул АТФ.
В упрощенном виде ресинтез АТФ аэробным путем может быть представлен схемой:
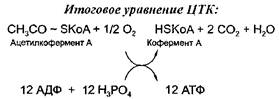
Чаще всего водород отнимается от промежуточных продуктов цикла трикарбоновых кислот - цикла Кребса. Цикл Кребса - это завершающий этап катаболизма, в ходе которого происходит окисление ацетилкофермента А до С02 и Н20. В ходе этого процесса от перечисленных выше кислот отнимается 4 пары атомов водорода и поэтому образуется 12 молекул АТФ при окислении одной молекулы ацетилкофермента А.
 2015-06-26
2015-06-26 592
592








