Затруднения классической физики при объяснении спектральных закономерностей при поглощении и излучении веществами энергии частично были разъяснены датским физиком Нильсом Бором в 1913 году. Его анализ проблемы атомного излучения привел к неожиданному с точки зрения физика начала XX века выводу: «ошибочно убеждение, что область применимости представлений классической физики беспредельна, она ограничена явлениями в макросистемах (L>>10-8 см); представления классической физики неприменимы к событиям в микросистемах (атомах, молекулах), которые поэтому она не в состоянии описать».
Для объяснения совокупности известных фактов, и прежде всего фактов, касающихся строения и свойств излучаемых газами спектров, Бор предложил теорию атомов, в основу которой похожих три постулата.
Для того, чтобы объяснить устойчивость экспериментально установленной Резерфордом планетарной структуры атомов Бор допустил, что внутриатомное движение не во всем следует законам классической физики и в частности - что результаты классической электродинамики неприменимы к внутриатомным процессам.
Своеобразие атомного движения по Бору проявляется в том, что могут иметь место случаи движения заряженной частицы по замкнутым орбитам (т.е. движения заряженной частицы с ускорением), которые не будут сопровождаться излучением энергии. Наблюдения, в том числе опыты Резерфорда, указывают на такой характер внутриатомного движения. Далее, движение электронов вокруг ядра таково, что не все мыслимые траектории возможны.
Эту мысль бор выразил в форме первого постулата своей теории: «из бесконечного числа электронных орбит, возможных с точки зрения классической физики, в действительности осуществимы только некоторые определенные стационарные орбиты. При движении электрона по любой из этих орбит, несмотря на то, что он движется с ускорением, электрон, вопреки классической электродинамике, не излучает анергии.
На неизбежный вопрос, как выделить эти дискретные орбиты из числа возможных с точки зрения классической физики орбит, дает ответ второй постулат бора: «из всех возможных с точки зрения классической физики орбит в атоме осуществляются только те, для которых момент количества движения n электрона равен целому кратному величины h/2π, то есть

где n = 1, 2, 3, 4 и т.д.»
В том случае, если электрон массы m со скоростью Vn движется по круговой стационарной орбите номера n и радиуса rn, то его момент количества движения n равен
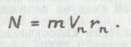
Отсюда для круговых стационарных орбит равенство (1.38) примет вид

Анализируя спектральные закономерности атомных спектров, Бор первый понял, что комбинационный принцип отражает своеобразие законов, управляющих внутриатомными движениями. Обобщая и опираясь на идею Планка о дискретности энергетических состояний атомных вибраторов в твердом теле, он понял, что комбинационный принцип указывает на возможность для атомов и в свободном состоянии изменять энергии не любым образом, а только дискретно.
Эту мысль он сформулировал в третьем постулате: излучение испускается или поглощается атомом при переходе электрона из одного квантового (стационарного) состояния в другое (при квантовом скачке). Причем разность энергии этих двух состояний излучается или поглощается в виде светового кванта анергии hν).
Таким образом, воли E1 — энергия одного стационарного состояния, а E2, энергия другого, те при переходе атома из состояния E2 в состояние E1 (E1 < E2) излучается (поглощается, если E1 > E2) квант энергии

где h - постоянная Планка, ν - частота излучаемой линии.
Это состояние часто называй боровским условием частот. Оно выражает закон сохранения энергии.
С другой стороны, боровское условие частот не что иное как комбинационный принцип, выраженный иным, чем это делал В. Ритц, способом: каждая спектральная линия связана с двумя стационарными состояниями атома. Действительно, если Е2-Е1=hν, то

Обозначив
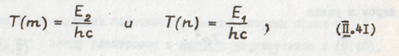
Получим
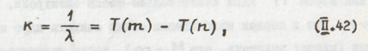
то есть известную нам аналитическую формулировку комбинационного принципа.
Таким образом, постулаты Бора по существу являются обобщением экспериментальных фактов, формулировкой на их основе характерных, специфических особенностей внутриатомного движения.
Опишем на основании теории Бора спектральные закономерности водородоподобиого атома.
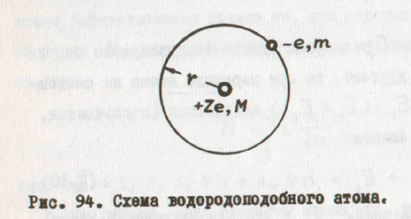
Водородоподобный атом - система, состоящая на ядра с зарядом +Ze и одного электрона (рис. 94). При Z=1 - это атом водорода, Z = 2 - однократно ионизированный атом гелия и т.д.
Взаимодействие между ядром и электроном - кулоновское. Это установили опыты Резерфорда.
Предположим, что электрон движется по круговой орбите. Вычислим энергию нашей системы (атома водорода). Полная энергия атома складывается из кинетической W и потенциальной U энергий.
Потенциальная энергия обусловлена взаимодействием электрона с ядром и равна

Так как масса М ядра много божьим массы электрона, то есть М» m, то в первом приближении можно считать ядро атома неподвижным (иначе: полагать, что М →∞), тогда кинетическая анергия системы

где V - скорость движения электрона по орбите. Следовательно, полная анергия Е будет:

Движение по криволинейной траектории есть движение о ускорением - это центростремительное ускорение электрону сообщает кулоновская сила взаимодействия его с ядром. Для этого случая движения центробежная сила компенсируется центростремительной, то есть кулоновской силой

Отсюда находится связь между кинетической и потенциальной энергиями. Сократив (П.46) на r, получим
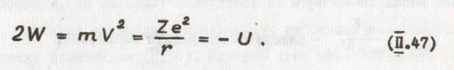
Таким образом, полная энергия атома Е равна
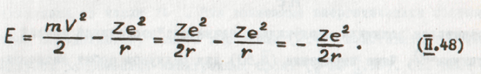
На рисунке 95 изображена зависимость полной энергии атома от расстояния r между электроном и ядром в соответствии с (1.48).
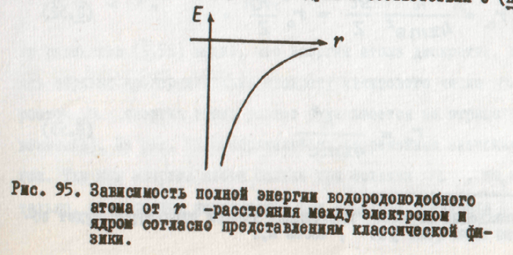
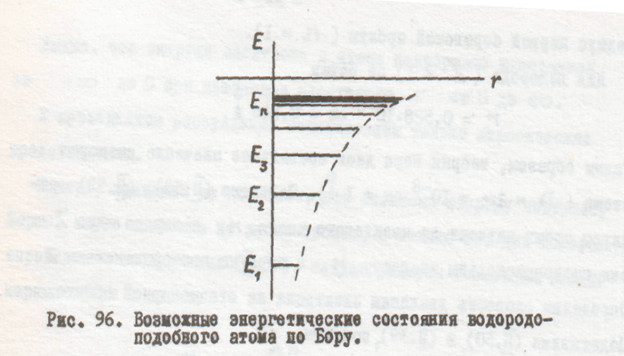
Теперь можно уточнять возможные энергетические состояния электрона в атоме. Так как электрон может двигаться только по стационарным орбитам, то он может находиться от ядра не на любом расстоянии, а только на вполне определенных набранных расстояниях. Поэтому атом может обладать не любой энергией, а только некоторыми разрешенными значениями ее, зависящими от числа n. Эти возможные энергетические состояния атома определяются, если в выражение (П.48) подставить значение радиусов разрешенных электронных орбит (ф-ла П.50). Это дает
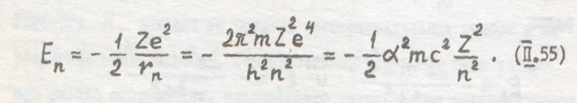
Из равенства (П.55) видно, что энергия атома дискретна, изменяясь обратно пропорционально квадрату квантового числа п. С ростом п. Энергия атома растет (уменьшается ее отрицательная величина). На рис. 96 изображены эти разрешенные значения анергии.
Шимони
 2015-06-24
2015-06-24 2230
2230
