d=(m/(p NА))1/3.
Произведем вычисления
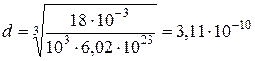 м.
м.
Ответ: 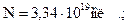
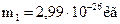 ;
; 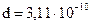 м.
м.
Задача 3
В баллоне объемом 10 л находится гелий под давлением p1=1 МПа и при температуре T=300 К. После того как из баллона было взято m=10 г гелия, температура газа понизилась до Т=290 К. Определить давление гелия оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева–Клапейрона, применив его дважды к начальному и конечному состояниям газа:
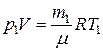 ;
;
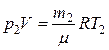 ,
,
где m1, m2 – масса гелия в баллоне в начальном и конечном состояниях;
μ – молярная масса гелия;
R – универсальная газовая постоянная;
T1 и T2 – температуры газа в начальном и конечном состояниях.
Массы m1 и m2 гелия найдем из уравнения Менделеева–Клапейрона:
m1=p1mV/RT1,
m2=μp2V/RT2.
Тогда масса гелия оставшегося в баллоне будет равна
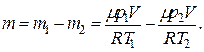
Для давления (p) гелия, оставшегося в баллоне, будем иметь:
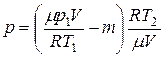
или
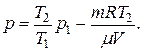
Численно
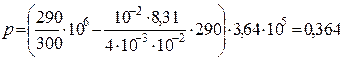 МПа.
МПа.
Ответ: p=0,364 МПа.
Задача 4
Баллон содержит 80 г кислорода и 320 г аргона. Давление смеси 1МПа, температура 300 К. Принимая данные газы за идеальные, определить объем баллона.
Решение. По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальные давления кислорода p1 и аргона p2 можно определить, воспользовавшись уравнением Менделеева – Клапейрона
p1=m1RT/(m1V);
p2=m2RT/(m2V).
По закону Дальтона, давление смеси газов
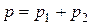 или
или 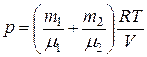
откуда объем баллона
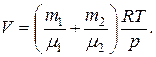
Подставив численные значения, будем иметь:
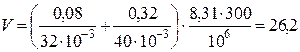 ×10-3 м3.
×10-3 м3.
Ответ: V=26,2×10-3 м3.
Задача 5
Какое количество молекул находится в комнате объемом 80м3 при температуре 17 oС и давлении 750 мм. рт. ст.?
Решение. Количество молекул N, содержащееся в комнате, можно определить, зная массу воздуха m,его молярную массу μ и число Авогадро NА. Число молекул в одном киломоле газа равно числу Авогадро. А число киломолей содержащихся в массе m, определяется соотношением:
n=m/m.
Следовательно,
N=m/(mNА).
Массу m содержащегося в комнате воздуха определяем из уравнения Менделеева–Клапейрона 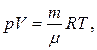
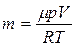 ,
,
где p – давление воздуха;
V – объем;
R – универсальная газовая постоянная;
T – абсолютная температура (T=t+273);
m – масса воздуха.
Следовательно, для числа молекул воздуха имеем:
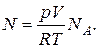
Подставляя все данные, предварительно выразив их в системе СИ, будем иметь
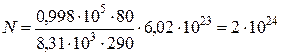 молекул.
молекул.
Ответ: N=2×1024 молекул.
1. Решите задачу из задачника [2] (ПК-1, ПК-3) № 5,12; 5,13; 5,14; 5,15; 5,16; 5,19; 5,20; 5,21; 5 22; 5.28.
Тема № 9 «Кинетическая теория газов»
Вопросы для самостоятельного изучения
1. Как определить среднеквадратичную скорость молекулы газа, зная скорость каждой молекулы и их количество в сосуде?
1. Как связан модуль вектора скорости молекулы с его проекциями на оси x, y, z? Указание – для получения этой формулы совместите начало вектора с началом координат и постройте его проекции.
3. Напишите формулу для среднеквадратичной скорости молекулы через молярную массу и универсальную газовую постоянную.
4. Атмосферный воздух является смесью газов, и молекулы водорода, например, движутся быстрее молекул кислорода. Как это объяснить с помощью закона изменения импульса, считая, что все молекулы испытывают абсолютно упругие соударения друг с другом?
5. Поступательное движение молекулы можно описать с помощью трех независимых координат. Многоатомные – 2-х, 3-х и более – молекулы могут совершать также вращательное и колебательное движение. Сколькими независимыми координатами можно описать вращательное движение 2-х и 3-х атомной молекулы?
5. Что такое наиболее вероятная, средняя и среднеквадратичная скорости молекул?
6. Каков смысл функции распределения Максвелла?
7. Как меняется концентрация молекул с увеличением их потенциальной энергии?
 2015-07-03
2015-07-03 2720
2720








