Тогда искомая часть молекул, которую необходимо определить
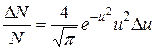 .
.
В нашем случае v=100 м/с; Δv=10 м/с; наиболее вероятная скорость v=(2RT/pm)1/2=376 м/с. Следовательно, u=v/vв=100/376, u2=0,071; Du=10/376; exp(–u2)=0,93.
Тогда
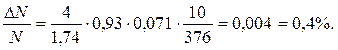
Ответ:ΔN/N=0,4%.
Задача 3
Сосуд, содержащий газ, движется со скоростью vo, затем быстро останавливается. На сколько увеличится при этом средний квадрат скорости теплового движения молекул газа в случаях: одноатомного газа, двухатомного газа? Газ считать идеальным.
Решение. Воспользуемся законом сохранения энергии. Пусть M масса газа в сосуде. Двигаясь со скоростью v газ, как целое, обладает кинетической энергией
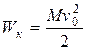 .
.
Эта формула определяет кинетическую энергию направленного движения молекул, в котором они участвуют вместе с сосудом. После остановки сосуда направленное движение молекул в результате их соударений со стенками сосуда очень скоро превратится в хаотическое.
Пренебрегая теплообменом между газом и стенками сосуда за рассматриваемый промежуток времени, можно газ считать изолированной системой. Тогда из закона сохранения энергии следует, что «исчезнувшая» кинетическая энергия направленного движения молекул W должна быть равна приросту энергии хаотического движений молекул (приросту внутренней энергии DU):
Wк=DU.
Определим внутреннюю энергию газа. Для идеального одноатомного газа это есть энергия поступательного хаотического движения молекул:
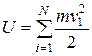 ,
,
где m – масса молекулы;
N – число молекул в сосуде.
Имеем
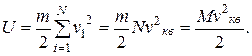
Отсюда следует, что изменение внутренней энергии одноатомного газа при торможении
DU=U2-U1= 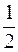 M[v2кв2-v2кв1],
M[v2кв2-v2кв1],
где vкв1,vкв2 – средние квадратичные скорости молекул газа соответственно в начале и конце торможения.
Подставив в уравнение Wк=DU значения Wк и DU, получим первый ответ
v2кв2–v2кв1=v02.
Внутренняя энергия идеального двухатомного газа складывается из энергий поступательного и вращательного движения молекул. При этом три степени свободы приходятся на поступательное движение и две – на вращательное. В соответствии с законом о равномерном распределении энергии по степеням свободы, три пятых кинетической энергии W пойдет на увеличение энергии поступательного движения молекул и две пятых – на увеличение энергии их вращательного движения. Таким образом, имеем:
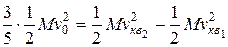 .
.
Из последнего соотношения получим второй ответ:
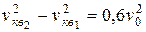 .
.
Ответ: 1) 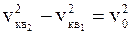 ;
; 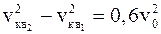 .
.
Задача 4
Какая часть молекул водорода, находящегося при температуре T, обладает скоростями, отличающимися от наиболее вероятной скорости не свыше чем на 5,0 м/с? Задачу решить для двух значений T: 1) 400 К, 2) 900 К.
Решение. Распределение молекул по скоростям выражается законом Максвелла: число молекул DN, относительные скорости которых лежат в интервале от u до u + Du:
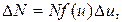
где N – полное число молекул газа;
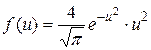 – функция распределения Максвелла;
– функция распределения Максвелла;
u=v/vв – относительная скорость;
v – данная скорость;
vв – наиболее вероятная скорость.
Закон распределения Максвелла оказывается справедливым при условии Du<u. Поскольку в задаче идет речь о наиболее вероятной скорости, надо считать v=vв. Следовательно, u=v/vв=1 и выше написанное уравнение примет более простой вид:
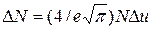 .
.
Отсюда найдем ту часть молекул, относительные скорости которых лежат в интервале Du:
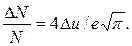
Прежде чем производить расчеты, необходимо убедиться в том, что выполняется условие Du<u. Так как u=v/vв , то Du=Dv/vв.
Чтобы вычислить Du, найдем сначала наиболее вероятную скорость при Т=400 К и Т=900 К по формуле:
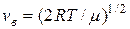 :
:
vв1=2×8,31×400/0,002=1,82×103 м/с,
vв2=2×8,31×900/0,002=2,73×103м/с.
Подставляя эти значения vв и имея в виду, что Dv=10 м/с, поскольку в задаче идет речь о скоростях, лежащих в интервале от vв=--5,0 м/с до vв=5,0 м/с, получим:
Du1=1/182, Du2=1/273.
Так как u=1, видим, что условие Du<u выполняется для обеих температур.
Теперь найдем
DN1/N=4/((3,14)1/2×2,7×182)=0,0046,
DN2/N=4/((3,14)1/2×2,7×273)=0,0030.
Таким образом, при увеличении температуры наиболее вероятная скорость молекул увеличивается, а число молекул, скорости которых лежат в одном и том же интервале около наиболее вероятной, уменьшается.
Ответ: DN1/N=0,0046, DN2/N=0,0030.
Задача 5
Какая часть молекул газа имеет скорости превышающие наиболее вероятную?
Решение. В условии задачи речь идет о молекулах, скорости которых заключены в интервале от наиболее вероятной скорости v до v+Dv, т.е. в бесконечно большом интервале скоростей. Таким образом, условие применимости закона распределения скоростей, заключающееся в том, что Du<u, или Dv<v, здесь не выполняется. Поэтому от уравнения в форме:
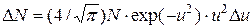
надо перейти к дифференциальной форме этого закона
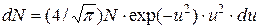
Полное число DN молекул, относительные скорости которых лежат в заданном интервале от u1 до u2, найдем, интегрируя правую часть в этих пределах:
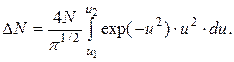
 2015-07-03
2015-07-03 2933
2933
