Цикло-оксо-таутомерия. Моносахариды являются таутомерными веществами. В кристаллическом состоянии они имеют циклическое строение. В водном растворе циклическая форма через открытую оксоформу превращается в другие циклические формы — пиранозные и фуранозные. Цикло-оксо-таутомерия объясняет отсутствие некоторых реакций на альдегиды.
Таким образом, в водном растворе моносахариды существуют в виде пяти таутомерных форм: открытой, α- и β-пиранозных и α- и β- фуранозных.
Такой вид таутомерии называется цикло-оксо-таутомерией, или кольчато-цепной.
Переход одной формы в другую происходит непрерывно. В определенный момент наступает динамическое равновесие, при котором количество всех форм становится постоянным.
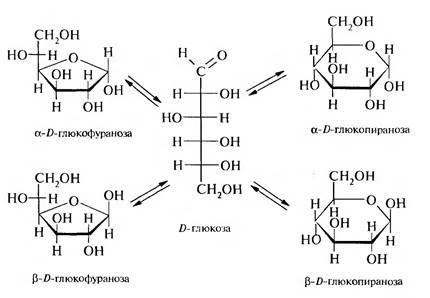
В равновесной смеси преобладают пиранозные формы: - 63% β-D-глюкопиранозы и 36% α-D-глюкопиранозы. Фуранозные формы и открытая форма присутствуют в очень маленьких количествах.
Способность моносахаридов к цикло-оксо-таутомерии объясняет явление мутаротации.
Мутаротация — это изменение величины угла удельного вращения свежеприготовленных растворов оптически активных соединений.
Вначале в свежеприготовленном растворе глюкозы наблюдается величина угла удельного вращения 112° (α-D-глюкопираноза), через некоторое время величина угла становится равной +52,5° и остается неизменной, что есть результатом установившегося динамического равновесия между пятью таутомерными формами моносахаридов.
Карбонильно-ендиольная таутомерия. Как известно, альдегидная группа проявляет электроноакцепторные свойства, это вызывает поляризацию связи С1—С2, атом водорода при С2 становится подвижным и мигрирует к атому кислорода карбонильной группы. При этом образуется ендиольная форма.
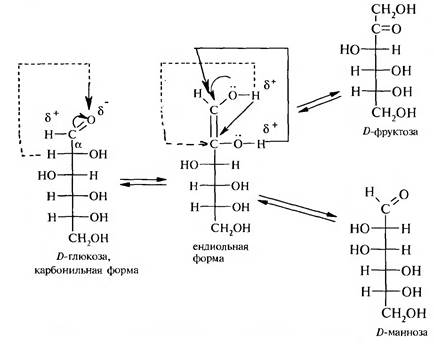
Такие превращения протекают в слабощелочной среде. В ендиольной форме при двойной связи имеются две равноценные гидроксильные группы. Согласно правилу Эльтекова, гидроксильная группа не может находиться при атоме углерода с двойной связью, вследствие p,π-сопряжения. В зависимости от того, какой гидроксил в данный момент времени будет вступать в сопряжение, образуются либо альдегидная, либо кетонная формы моносахаридов. Ендиольная форма является общей для эпимеров. Она едина для эпимерных моносахаридов D-глюкозы и D-маннозы и изомерной им D-фруктозы.
Моносахариды — это бесцветные кристаллические вещества, растворимые в воде, спирте, не растворяются в эфире. Большинство из них сладкие на вкус, но встречаются и горького вкуса.
Способы получения
Кислотный гидролиз полисахаридов является важнейшим способом получения моносахаридов:
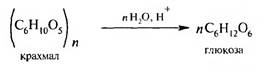
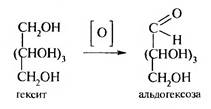
Окисление многоатомных спиртов. При окислении пятиатомных спиртов образуются пентозы, а шестиатомных — гексозы.
Химические свойства моносахаридов
Являясь полигидроксикарбонильными соединениями, моносахариды проявляют свойства карбонильных соединений, многоатомных спиртов и циклических полуацеталей.
Химические превращения в ряду моносахаридов можно условно разделить на две группы:
• реакции при участии открытых форм моносахаридов;
• реакции при участии циклических форм.
I. Реакции открытых форм моносахаридов
1. Общая реакция на углеводы (проба Молиша). При действии на углеводы кони. H,S04 и α-нафтола образуется фиолетовое окрашивание. В химическом отношении вначале образуется фурфурол или 5- гидроксиметилфурфурол, которые конденсируются с α-нафтолом и образуют окрашенные продукты.
2. Отношение к действию минеральных кислот (внутримолекулярная дегидратация). Альдопентозы при нагревании с минеральными кислотами (НС1, H2S04) образуют фурфурол, который с анилином дает красное окрашивание, а с флороглюцином — кристаллический осадок.
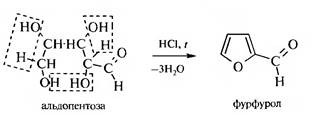
При взаимодействии альдогексоз с минеральными кислотами выделяется 3 молекулы Н20 и образуется нестойкий 5-гидроксиметил- фурфурол, который разлагается с образованием муравьиной и левулиновой кислот:
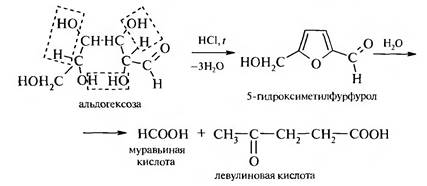
5-Гидроксиметилфурфурол дает красное окрашивание с резорцином. Данная реакция имеет аналитическое значение и позволяет отличить пентозы от гексоз.
3. Специфическая реакция на кетозы (реакция Селиванова). Кетозы легче, чем альдозы, превращаются в 5-гидроксиметилфурфурол, который является нестойким соединением. Он взаимодействует с резорцином в среде хлороводородной кислоты в момент выделения с образованием вишневокрасного окрашивания.
Альдозы эту реакцию дают, но в течение длительного времени.
4. Окисление. Моносахариды легко окисляются, но, в зависимости от природы окислителя и условий окисления, образуются разные продукты.
• Окисление в кислой и нейтральной среде:
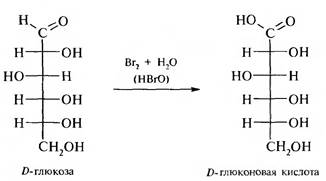
При действии слабых окислителей (бромной воды или разбавленной азотной кислоты) альдозы окисляются до одноосновных альдоновых кислот.
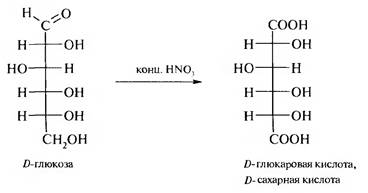
Сильные окислители, такие, как концентрированная азотная кислота, окисляют в молекуле альдоз альдегидную и первичную спиртовую группы с образованием дикарбоновых гидроксикислот, которые называются альдаровые, или сахарные, кислоты:
При избирательном окислении в молекуле альдозы первичной спиртовой группы без участия очень склонной к окислению альдегидной группы образуются уроновые кислоты.
Окисление в этом случае проводят, предварительно защитив альдегидную группу.
• Окисление в щелочной среде.
Подобно альдегидам, моносахариды окисляются аммиачным раствором оксида серебра (реактив Толленса), гидроксидом меди (II) в щелочной среде (реактив Троммера) или же реактивом Фелинга. При окислении в щелочной среде моносахариды расщепляются до смеси продуктов окисления.
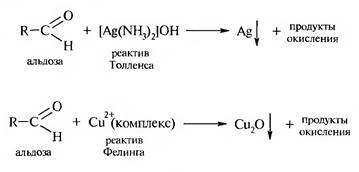
Эти реакции являются качественными на альдозы и кетозы.
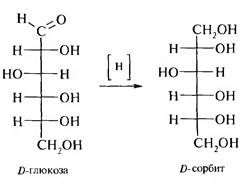
5. Восстановление. При восстановлении моносахаридов водородом в присутствии катализатора (Ni, Pd) образуются многоатомные спирты.
Из D-глюкозы образуется D-сорбит, из D-маннозы — D-маннит, из D-ксилозы — D-ксилит и т. д.
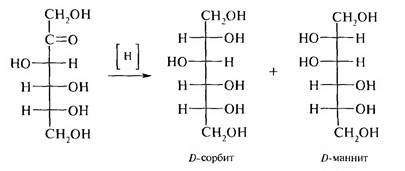
Фруктоза при восстановлении образует смесь двух шестиатомных спиртов D-сорбита и D-маннита.
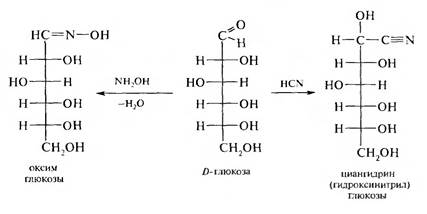
6. Реакции с участием оксогруппы. Альдозы, подобно альдегидам, легко вступают в реакцию с циановодородной кислотой с образованием циангидринов. При взаимодействии с гидроксиламином образуются оксимы.
Взаимодействие с фенилгидразином (образование озазона). При нагревании моносахаридов с фенилгидразином в соотношении 1:3 образуются бис-фенилгидразоны. которые получили название озазонов:
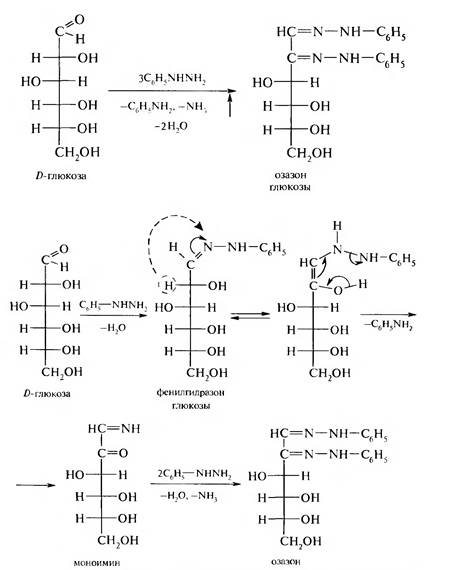
Эпимеры D-глюкоза и D-манноза и изомерная им фруктоза образуют один и тот же озазон.
Образование озазона используется для определения подлинности моносахаридов.
II. Реакции при участии циклической формы
1. Образование гликозидов. Моносахариды, являясь циклическими полуацеталями, реагируют в присутствии кислотного катализатора со спиртами и фенолами с образованием циклических ацеталей — гликозидов.
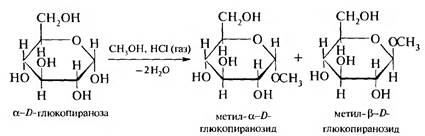
Гликозиды построены по типу простых эфиров. Молекулы гликозидов состоят из сахарной части и агликона (несахарная часть). Гликозиды широко представлены в растительном мире, являются важными биологически активными соединениями. Примером могут быть сердечные гликозиды, флавоноиды и др.
В названии гликозида должно быть отражено все: исходный моносахарид, величина цикла, конфигурация, радикал (несахарная часть), его расположение.
Например:
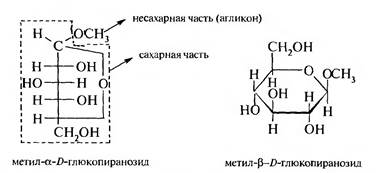
Окончание - ид указывает на отсутствие в молекуле свободного полуацетального гидроксила.
Гликозиды фуранозного строения приблизительно в 100 раз менее стойки, чем гликозиды пиранозного строения.
Гликозиды устойчивы к действию щелочей, но в водных растворах кислот они гидролизуются.
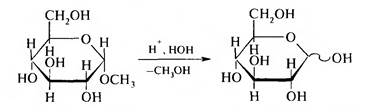
При гидролизе происходит расщепление гликозида на агликон и сахарный компонент и образуется смесь α- и β-аномеров глюкопиранозы.
Гликозиды не способны мутаротировать.
В природе встречаются самые различные гликозиды. В качестве аг- ликонов могут быть кислородсодержащие соединения, стероиды и моносахариды. Связь агликона с аномерным атомом углерода осуществляется через атом кислорода, поэтому такие гликозиды называются О-гликозидами. N-гликозиды содержат в качестве агликона алифатические, ароматические амины или N-содержащие гетероциклические амины. S-гликозиды — производные тиоспиртов и тиофенолов.
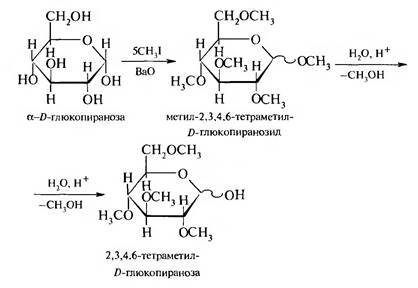
2. Алкилирование. При взаимодействии моносахаридов с галогенал- канами или диметилсульфатом (CH3)2S04 алкилированию подвергаются все гидроксильные группы, включая и полуаиетальный гидроксил. В кислой среде такие соединения гидролизуются только по гликозидной связи:
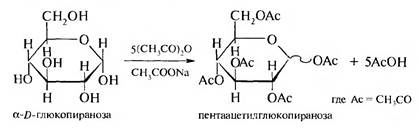
3. Ацилирование. При ацилировании моносахаридов ангидридами карбоновых кислот легко образуются сложные эфиры:
Отдельные представители
К производным моносахаридов относится аскорбиновая кислота (витамин С) и глюкозамин — представитель аминосахаров.
 2015-08-12
2015-08-12 4443
4443








