Б2.Б.4 ОСНОВЫ ОБЩЕЙ И НЕОРГАНИЧЕСКОЙ ХИМИИ
Модуль 2 Дисперсные системы
направление подготовки бакалавра
Продукты питания из растительного сырья
Продукты питания животного происхождения
Уфа - 2013
УДК
Рекомендовано к изданию методической комиссией
факультета пищевых технологий
(протокол №_______ от «______» ________________________ 2013 г.)
\
Составитель: доцент Ганиева Е.С.
Рецензент:
доцент кафедры химии Шабаева Г.Б..
Ответственный за выпуск:
заведующий кафедрой химии профессор Исламова Р.М.
Модуль 2 Дисперсные системы
Дисперсная система (ДС) – это система, в которой хотя бы одно вещество находится в раздробленном состоянии.
ДС имеет два характерных признака: гетерогенность и дисперсность. Гетерогенность означает, что система состоит как минимум из двух фаз, причем одна из фаз раздроблена. Это дисперсионная фаза. А другая, сплошная среда, в которой находится раздробленная дисперсная фаза, дисперсионная среда.
Для характеристики ДС используются три величины:
1. Поперечный размер частиц – d, см, м.
2. Дисперсность (раздробленность) – Д – величина, обратная поперечному разделу частиц, cм-1, м-1
3. Удельная поверхность Sуд – это межфазная поверхность (S1,2), приходящаяся на единицу объема (V) дисперсной фазы или ее массы (m),, cм-1, м-1, см2×г-1, м2×кг-1.
Классификация по агрегатному состоянию фаз была предложена Вольфгангом Оствальдом.
| Агрегатное состояние ДФ | Агрегатное состояние ДСр | Условное обозначение ДФ/ДСр | Название системы | примеры |
| г | г | г/г | аэрозоли | атмосфера Земли |
| ж | г | ж/г | туман, слоистые облака | |
| тв | г | тв/г | дымы, пыли, перистые облака | |
| г | ж | г/ж | газовые эмульсии, пены | мыльная пена, лечебный кислородный коктейль, пивная пена |
| ж | ж | ж/ж | эмульсии | молоко, масло сливочное, маргарин, кремы |
| тв | ж | тв/ж | лиозоли, суспензии | лиофобные коллоидные растворы, суспезии, пасты, краски и т.д. |
| г | тв | г/тв | твердые пены | пемза, твердые пены, активированный уголь, хлеб |
| ж | тв | ж/тв | твердые эмульсии | природные минералы с жидкими включениями |
| тв | тв | тв/тв | твердые золи | сталь, чугун, цветные стекла |
В зависимости от размера частиц дисперсной фазы ДС классифицируются на: 1) Грубодисперсные системы, d ³ 10-3 см;
1) Микрогетерогенные системы, 10 -5 £ d £ 10 -3 см;
2) Коллоидно-дисперсные системы или коллоидные растворы,
10 -7 £ d £ 10 -5 см;
3) Истинные растворы, d ³ 10-7 см.
Самую большую удельную поверхность имеют частицы дисперсной фазы в коллоидных растворах.
Классификация по взаимодействию дисперсной фазы и дисперсионной среды (по межфазовому взаимодействию) пригодна только для систем с жидкой дисперсионной средой. Г. Фрейндлих предложил подразделить ДС на два вида:
1) Лиофобные – в них ДФ не способна взаимодействовать с ДСр, а следовательно, и растворяться в ней. К ним относятся коллоидные растворы, микрогетерогенные системы;
2) Лиофильные – в них ДФ ввзаимодействует с ДСр и при определенных условиях способна в ней растворяться. К ним относятся растворы коллоидных ПАВ и растворы ВМС.
Определить к какой системе – микрогетерогенной, коллоидной, истинной – относится раствор можно по его оптическим свойствам. Белый свет (дневной, солнечный) полихроматичен, длина волны меняется от 4 × 10-5 см (фиолетовый свет) до 7 × 10-5 см (красный свет). Прохождение света наблюдается для прозрачных систем, в которых частицы гораздо меньше длины волны падающего света. Это характерно для истинных растворов. Преломление и отражение наблюдается для систем, в которых частицы дисперсной фазы значительно больше длины волны падающего света. Визуально это выражается в мутности этих систем и характерно для микрогетерогенных и грубодисперсных систем. Рассеяние света (опалесценция) наблюдается для систем, в которых частицы дисперсной фазы меньше, но соизмеримы с длиной волны падающего света. Такое соотношение выполняется для коллоидных растворов.
В курсе общей химии мы познакомимся с коллоидными растворами и с некоторыми микрогетерогенными системами и подробно изучим свойства истинных растворов.
Лабораторная работа №1.
Получение и свойства дисперсных систем.
Цель работы: 1)получить различными методами дисперсные системы; 2) познакомиться с некоторыми свойствами дисперсных систем.
Задачи: 1) получить методом диспергирования микрогетерогенные системы: пену, эмульсию; 2) определить тип эмульсии: м/в или в/м; 3) определить кратность пены; 4) методом конденсации получить золь гидроксида железа, золь берлинской лазури; золь серы; золь канифоли; 5) убедиться в оптических свойствах дисперсных систем; 6) методом капилляризации определить заряд коллоидной частицы; 7) изучить коагуляцию коллоидных систем.
Все дисперсные системы могут быть получены двумя методами: методом диспергирования или методом конденсации. Метод диспергирования основан на дроблении или измельчении крупных частиц до агрегатов нужного размера. Метод конденсации основан на укрупнении (объединении) молекул и ионов до частиц более крупного размера.
Пены ( г/ж ) – это грубодисперсные высококонцентрированные системы, в которых дисперсной фазой являются пузырьки газа, а дисперсионной средой – жидкость в виде тонких пленок. Пены имеют сотообразную структуру: пузырьки газа полиэдрической формы отделены друг от друга тонкими прослойками жидкости. Классификация пен основывается на такой важной характеристике, как кратность пены 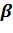 , которая показывает, сколько объемов пены можно получить из одного объема жидкости:
, которая показывает, сколько объемов пены можно получить из одного объема жидкости:
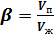 ,
,
где Vп – объем пены;
Vж – объем жидкости, которая использована для образования пены.
Если 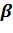 £ 10, то пены называют жидкими, их используют в строительстве.
£ 10, то пены называют жидкими, их используют в строительстве.
Если 10 £ 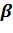 £ 20, то такие пены используют в прачечных.
£ 20, то такие пены используют в прачечных.
Пены с кратностью 70 £ 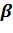 £ 90 используют в пожаротушении.
£ 90 используют в пожаротушении.
Если 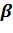 ³ 10, то пены относятся к сухим.
³ 10, то пены относятся к сухим.
Установлено, что образование сколько – нибудь устойчивой пены в чистой жидкости невозможно. Пену можно получить только в присутствии специального вещества - пенообразователя.
Эмульсии ( ж/ж) – это дисперсные системы, состоящие из двух несмешивающихся жидкостей, одна из которых (дисперсная фаза) распространена в другой (дисперсионной среде) в виде мельчайших капелек.
Различают эмульсии первого рода или прямые (М/В – масло в воде) – неполярные жидкости распределены в полярной жидкости. Эмульсии второго рода или обратные (В/М – вода в масле) – полярные жидкости распределены в неполярной жидкости. Тип эмульсии можно легко определить методом смешивания и методом окрашивания непрерывной среды. Для стабилизации эмульсий используют эмульгаторы. Разбавленные эмульсии по своим свойствам близки к лиофобным золям (тв/ж).
Частицы лиофобных золей имеют мицеллярное строение.
Мицелла в целом электронейтральная частица и состоит из:
а) электронейтрального ядра, представляющего собой микрокристалл или агрегат молекул низкомолекулярных соединений (например, mFe(OH)3, где т = 20…500);
б) адсорбционного слоя, в который входят с большим суммарным количеством зарядов потенциалопределяющие ионы и с меньшим суммарным количеством зарядов – противоионы (например, пFeO+(n – x)Cl-, где nFeO+ – потенциалопределяющие ионы, (n – x)Cl- -противоионы);
Потенциалопределяющие ионы определяются правилом Панета – Фаянса: на поверхности твердой частицы избирательно адсорбируются (концентрируются) только те ионы, которые способны достроить ее кристаллическую решетку.
в) диффузного слоя, включающего в себя такое дополнительное количество противоионов, которое необходимо для полной нейтрализации зарядов, имеющихся в мицелле, потенциалопределяющих ионов (например, xCl-).
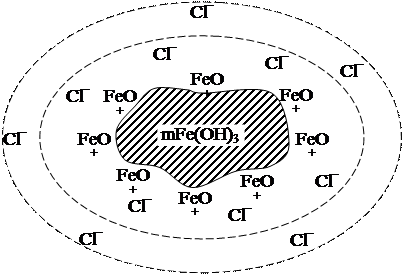

Рисунок 1 Схема строения мицеллы гидрозоля Fe(OH)3
Таким образом, вокруг ядра находится двойной электрический слой, один слой которого образован потенциалопределяющими ионами FeO+, а другой – противоионами Cl¯. Одна часть противоионов Cl¯ находится в адсорбционном слое, а другая часть – в диффузном слое (рисунок 1).
Формула мицеллы золя гидроксида железа:
{(mFe(OH)3)nFeO+(n – x)Cl-)}x+xCl-
Та часть мицеллы, которая находится внутри фигурных скобок, называется гранулой. Гранула представляет собой компактную частицу, состоящую из ядра и ионов адсорбционного слоя.
Знак заряда частицы можно определить методом капилляризации.
Для коллоидных систем различают 2 вида устойчивости:
а) агрегативная устойчивость – способность частиц коллоидной системы оказывать сопротивление их слипанию и тем самым удерживать определенную степень дисперсности дисперсной фазы;
б) кинетическая устойчивость – способность частиц дисперсной фазы удерживаться во взвешенном состоянии под действием броуновского движения.
Агрегативная устойчивость обусловлена:
– наличием у гранул одноименных зарядов;
– наличием диффузного слоя вокруг гранул, который не позволяет им объединится при их сближении.
При изменении условий коллоидная система сначала теряет агрегативную устойчивость – происходит укрупнение частиц дисперсной фазы, затем – кинетическую устойчивость (частицы выпадают в осадок или всплывают на поверхность). Подобное изменение состояния коллоидной системы, приводящее к укрупнению частиц дисперсной фазы, называется коагуляцией.
Коагуляцию можно вызвать путем добавления электролитов в коллоидную систему.
Влияние знака и величины заряда коагулирующего иона определяется правилом Шульце-Гарди: коагулирующим действием обладает лишь тот ион, который имеет заряд, противоположный заряду гранулы, причем его коагулирующая способность выражается тем сильнее, чем выше заряд иона. Порог коагуляции – это минимальное количество электролита (ммоль-экв), которое вызывает явную коагуляцию 1 л золя.
 2015-08-13
2015-08-13 879
879







