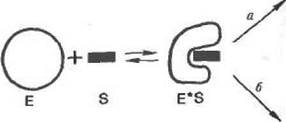
В простейшем случае скорость (v) катализируемой ферментом реакцни анализируется в рамках уравнения Михаэлиса— Ментен;
где [£]о и [S]o — концентрация фермента и субстрата в системе соответственно; к^т — каталитическая конгтантз ферментативной реакции; /СМлаж — определяемое эффективное (кажущееся) значение константы Михаэлиса.
Параметр Лм_язж служит характеристикой сродства фермента к субстрату нт следовательно, является мерой той концентрации субстрата, которая необходима для насыщения фермента. При катализе иммобилизованными ферментами концентрация субстрата вблизи фермента (локальная) может отличаться от концентрации субстрата во всем объеме системы. В этом случае наблюдаемая на опыте Кп.каж должна зависеть от распределения субстрата-между свободным раствором и носителем, где сосредоточен фермент. Что касается параметра ^„ат1 то он характеризует реакционную способность уже образовавшегося фермент—субстратного комплекса, поэтому не зависит от распределения субстрата в системе, а определяется состоянием, в первую очередь, конформици^й самого фермента.
Каталитические параметры ферментативной реакции (ftraT и Км.каж) могут зависеть от наличия в реакционной системе раз* личных эффекторов, таких, как ингибиторы и активаторы, ионы водорода и т. п. В таких случаях необходимо учитывать распределение также этих эффекторов между раствором и фермент-содержащей матрицей.
Таким образом, все кинетические эффекты, наблюдаемые при катализе иммобилизованными ферментами, можно разделить на две группы. К первой из них относятся эффекты, связанные с влиянием иммобилизации на состояние (конформацию) фермента, а ко второй — эффекты, обусловленные распределением реагентов в системе.
§ 2. Влияние иммобилизации на состояние фермента
Информационные свойства иммобилизованных ферментов. При иммобилизации существует опасность, что белок присоединится к носителю в конформацни, отличной от нативной. В этом случае каталитическая активность фермента может существенно измениться или вообще исчезнуть.
Вопрос о том, произошли ли в белке конформационные изменения при иммобилизации, решается исследованием структург>1 иммобилизован мы к ферментов физическими методами. Для этой цели с успехом использовали оптические методы (спектрофото-метрическии, флуоресцентный), метол спиновых меток и др. Анализируя данные этих исследований, можно сделать следующие выводы.
1. В результате иммобилизации пространственная структура фермента может либо существенно измениться, либо измениться незначительно, либо остаться неизменной (что наблюдается чаще всего).
2. В тех случаях, когда конформация нативного и иммобилизо-
ванного ферментов различается, это обусловлено одной из трех причин. Во-перных, конформационпые различия могут быть обусловлены химической модификацией каких-либо важных д^я структуры функциональных групп белка и не связаны с самим процессом иммобилизации фермента (т. е. его присоединением к носителю). Чтобы устранить действие этого фактора, необходимо выбрать соответствующий метод иммобилизации не затрагивающий этих функциональных групп в белке. Кроме того» часто фермент удается защитить от инактивации на стадии иммобилизации простым добавлением субстрата или другого специфического л и ганда в насыщающей концентрации, что позволяет получать препараты с более высокой удельной каталитической активностью (т, е. активностью» отнесенной к I r носи-теля}-
Во-вторых, причиной искажения структуры фермента могут быть неспецифические взаимодействия (электростатические, гидрофобные, водородные связи) между ферментом и носителем, приводящие к денатурации. Чтобы избежать этих взаимодействий, иногда достаточно заменить носитель на инертный по отношению к белку. Такой инертностью обычно обладают поли-сахаридные носители, пол и акрил амид и некоторые другие. Если замена носителя по какой-либо причине нежелательна, то используют следующий методический прием: отдаляют белковые молекулы от поверхности носителя за счет увеличения длины «ножки» (сшивающего агента). При этом, как правило, удается ослабить неблагоприятное для фермента воздействие носителя.
И наконец, третьей возможной причиной различия структур нативного и иммобилизованного ферментов может быть большое число связей между ферментом и носителем.
3, В принципе может реализоваться такая ситуация, когда в результате иммобилизации конформация фермента практически не изменяется, но нарушается динамика конформационных изменений в белке. Так, у белков, связанных с носителями, могут замедляться необходимые для катализа кенформационные переходы, уменьшаться число конформационных стадий и глубина их протекания. Причиной этого являются неспецифические взаимодействия функциональных групп белка с носителем. Чтобы избежать их, необходимо, как показывает практика, проводить иммобилизацию на инертных носителях.
Фиксация «напряженных» состояний фермента. Иногда исследователи целенаправленно стремятся «закрепить» с помощью иммобилизации конформацию фермента, отличающуюся от нативной. Это, в частности, оказывается важным для детекции конформационных изменений в ферментах, индуцированных субстратами, кофакторами и другими специфическими ли ганда ми,
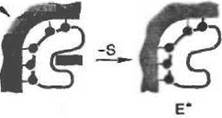
: Рассмотрим» как это делается (рис. Н). Комплекс фермента с субстратом или другим специфическим лигандомt образующийся в присутствии насыщающих концентраций этого лиганда,
 |

 |
 |
| E-S |
Рис, 14, Схематическое изображение фиксации с помощью иммобилизации «напряженной» конформации бедна,
сшивают бифунциональными агентами (стадия а на рис. 14) или присоединяют к предварительно активированному носителю (стадия б на рис. 14). После удаления лнгаида фермент остается зафиксированным в «напряженной» конформации.
Как показали многочисленные исследования, «замороженные» конформации фермента могут отличаться от обычных, ненапряженных состояний, реализуемых в тех случаях, когда иммобилизацию проводят в отсутствие специфических лигандов, ло целому ряду свойств: стабильности, доступности к действию модифицирующих агентов» сродству к субстрату и специфическим лигандам, а также каталитическим свойствам. Этот фактор необходимо учитывать, поскольку иммобилизацию фермента иногда рекомендуют проводить в присутствии специфических лнгандов с целью большей сохранности ферментативной активности.
§ 3. Эффекты распредепения реагентов в катализе иммобилизованными ферментами
Распределение субстрата, Б условиях равновесного распределения субстрата между раствором н ферментсодержащей матрицей Км.мж» входящая в уравнение (I), определяется следующим выражением:
JW™ = КМЯ, (2)
где Хм — значение константы Михаэлиса реакции, катализируемой свободным (нейммобилизованным) ферментом; Р — коэф~ фнциент распределения субстрата > который задается формулой
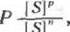 |
(3)

где [S]p и \S]H — концентрации субстрата в растворе и в матрице носителя соответственно.
Из уравнения (1) следует, что при высоких концентрациях субстрата (|5|»Км.*«ж) эффекты распределения не играют существенной роли, поскольку в этом случае скорость ферментативной реакции У = йкат[£], т. е. не зависит от концентрации субстрата. Если же концентрация субстрата невелика ([5]<AW(seHt), то анализ уравнений (I) —(3) показывает, что концентрирование субстрата в матрице (Р<:1) приводит к уменьшению значения /См,***, т. е. к возрастанию скорости ферментативной реакции. В тех же случаях, когда Р>1, скорость ферментативной реакции падает вследствие возрастания Ям.квж.
Неравномерность распределения субстрата в системе обусловлена его взаимодействием с матрицей за счет, например, электростатических сил, водородных связей, гидрофобных взаимодействий н т. п. В случае электростатических взаимодействий установлена количественная взаимосвязь между коэффициентом распределения Р н характеристиками субстрата и матрицы:
^*), (4)
где е — единичный заряд электрона; Z — заряд субстрата, кратный заряду электрона; ^ — электростатический потенциал носителя; k константа Больцмана; Т — абсолютная температура.
В заключение отметим, что в случае тех ферментов, которые характеризуются низким сродством к субстрату (высокое значение Км) или действуют на плохо растворимые субстраты (предел растворимости субстрата ниже значения Кил)> выбор носителя для иммобилизации приобретает первостепенное значение. В этих случаях, подобрав носитель, для которого коэффициент Pj>U можно добиться существенного увеличения скорости ферментативной реакции [см. уравнения (1) — (3)].
Диффузионные ограничении в катализе иммобилизованными ферментами. Если молекула фермента находится на поверхности (или внутри) частицы носителя, то для протекания ферментативной реакции необходимо, во-первых, чтобы молекула субстрата подошла к поверхности частицы, и, во-вторых, продиффундиро-вала внутрь нее. В зависимости от того, как соотносятся скорости диффузионных стадий и непосредственно ферментативной реакции, может реализоваться одна из трех нижеперечисленных ситуаций.
Если ферментативная реакция в поверхностных слоях частицы протекает быстрее, чем субстрат из раствора подходит к поверхности, то через непродолжительное время вокруг частицы образуется зона, обедненная субстратом. В результате наблюдаемая скорость ферментативной реакции будет определяться скоростью массопереноса субстрата к частице. В этом случае говорят, что процесс контролируется внешней диффузией.
Если массоперенос субстрата проходит быстрее, чем идет ферментативная реакция на поверхности частицы» то может возникнуть другой тип диффузионных затруднений. А именно, если размер частицы носителя велик» а фермент очень активен (или велика его плотность внутри частицы), то практически весь субстрат израсходуется уже в приповерхностных слоях носителя, а глубинные области будут обеднены субстратом. В таком случае говорят» что процесс контролируется внутренней диффузией.
И наконец, когда диффузия субстрата как к поверхностному слою, так и во внутренние области частицы проходит достаточно быстро, общая скорость превращения субстрата определяется непосредственно ферментативной реакцией. В этом случае говорят о кинетически контролируемом процессе.
Учет диффузионных факторов является одним из наиболее сложных вопросов в катализе иммобилизованными ферментами. В рамках уравнения Михаэлнса—Ментен [уравнение (l)J будет проанализировано влияние диффузионных факторов на эффективные кинетические параметры ферментативной реакции.
Внешнедиффузионное торможение. К поверхности частицы носителя примыкает неперемешиваемыи слой жидкости, в пределах которого перенос молекул происходит исключительно за счет молекулярной диффузии. Поскольку молекулярная диффузия в жидкостях проходит очень медленно {с коэффициентом диффузии 10~s—IO^cmVc), массоперенос может стать лимитирующей стадиен процесса, катализируемого иммобилизованным ферментом.
Согласно первому закону Фика диффузионная скорость подачи субстрата /, отнесенная к единице площади поверхности частицы носителя, пропорциональна градиенту концентрации субстрата, При наиболее часто распространенном случае линейного градиента концентрации
(5)
где р — коэффициент массо пере носа; So и 5 — концентрации субстрата в растворе и в частице с иммобилизованным ферментом соответственно.
При достижении стационарного состояния в системе, т. е. когда скорость диффузионного потока субстрата равна скорости его расходования в ферментативной реакции, справедливо следующее уравнение:
 где буквенные символы обозначают те же параметры системы, что и в уравнениях (I) — (5).
где буквенные символы обозначают те же параметры системы, что и в уравнениях (I) — (5).
Проанализируем частные случаи уравнения (6). В условиях насыщения фермента субстратом (Km, *aw <£; [ S]) кинетика ферментативной реакции описывается нулевым порядком по кои-
центрами и субстрата и ферментативный процесс не может лимитироваться диффузией, т. е. всегда протекает в кинетическом режиме,
В случае, когда /См.каж 2>[S|. т. е. когда кинетика ферментативной реакции подчиняется уравнению первого порядка, имеем следующее выражение для стационарной скорости ферментативной реакции:


 Анализ выражения (7) показывает, что возможны два крайних случая. Если р >• kK&t\ Щ/Км.ыж, т. е. массоперенос осуществляется намного быстрее, чем идет ферментативная реак-
Анализ выражения (7) показывает, что возможны два крайних случая. Если р >• kK&t\ Щ/Км.ыж, т. е. массоперенос осуществляется намного быстрее, чем идет ферментативная реак-
цня, то v — "aTl ' [So]. В этом случае реакция проходит в ки-
1\(Л кгж
нетическом режиме. Если же ферментативная реакция идет намного быстрее массопереноса, т. е. Э <£ кьат{Е]/Кгл.*а»., то ч-= р[5] и ферментативный процесс протекает в диффузионном режиме.
В общем случае, когда К(л,*аж ~|S], т. е. кинетика ферментативной реакции характеризуется дробным порядком по субстрату, несмотря на существенно более громоздкие выражения, по-прежнему справедлив вывод о двух режимах протекания ферментативного процесса - - кинетическом и диффузионном.
Можно ли решить заранее, в каком режиме, кинетическом или диффузионном, будет протекать ферментативная реакция? Для этого прежде всего необходимо оценить параметр р. Сравнив его со значением 1ь*ят[Е\/Кн,кяж, можно, в принципе, сделать вывод о режиме (кинетическом или диффузионном) протекания ферментативной реакции [см. уравнение (6)].
 2015-08-13
2015-08-13 1436
1436
