После изучения структуры силикатного стекла с помощью рентгеновских лучей было выяснено, что она представляет собой иррегулярную трехмерную сетку. Этот сетчатый каркас содержит промежуточные дырки, которые заняты более слабо удерживаемыми ионами натрия и лития (в зависимости от сорта стекла) и более сильно связанными ионами двух- и трехзарядных ионов.
Было показано, что для того, чтобы стеклянная мембрана функционировала как рН-электрод, она должна быть гидратирована. Негигроскопичные стекла не обладают рН-функцией. Стеклянная мембрана, выдержанная над осушителем, не реагирует на изменение рН. Чувствительность к ионам водорода восстанавливается после выдерживания электрода в течение нескольких часов в воде.
Экспериментально было доказано, что гидратация рН-чувствительных стеклянных мембран сопровождается обменной реакцией между однозарядными катионами стекла и ионами водорода раствора. В процессе обмена участвуют исключительно однозарядные катионы, поскольку двух- и трехзарядные катионы в структуре силиката связаны более прочно. Поэтому ионообменную реакции. Можно записать в виде:
Н+ (раствор) + Na+ (тв. стекло) ↔ Na+ (раствор) + Н+ (тв. стекло)
Константа равновесия этой реакции настолько велика, что поверхность гидратированной стеклянной мембраны состоит почти исключительно из кремниевой кислоты (H+HSiO3-), за исключением сильно щелочных сред, где концентрация ионов водорода чрезвычайно мала, а концентрация ионов натрия велика.
Если стеклянную мембрану выдерживать в воде в течение продолжительного времени, то слой геля кремниевой кислоты может достичь толщины 10-4-10-5 мм. На внешней стороне геля все пустоты заняты ионами водорода. При движении от поверхности внутрь геля наблюдается непрерывное уменьшение количества ионов водорода и соответственно увеличение количества ионов натрия. Схематическое изображение обеих поверхностей стеклянной мембраны представлено на рис. 7.
 |
| Внешний раствор | Слой гидратированного геля толщиной ~ 10-4 мм | Слой сухого стекла толщиной 0,1 мм | Слой гидратированного геля толщиной ~ 10-4 мм | Внутренний раствор |
| Пустоты на поверхности заняты ионами Н+ [Н+]=a1 | Пустоты заняты ионами Н+ и Na+ | Пустоты заняты ионами Na+ | Пустоты заняты ионами Н+ и Na+ | Пустоты на поверхности заняты ионами Н+ [H+]=a2 |
Рис. 7. Схема поверхностей вымоченной стеклянной мембраны
Подготовленный таким образом стеклянный электрод погружают в анализируемый раствор (внешний раствор). При этом протекает электродная реакция, сводящаяся к обмену ионами водорода между раствором и стеклянной мембраной, то есть электродная реакция не связана с переходом электронов:
Н+ (раствор) ↔ Н+ (тв. стекло)
Переносчиками электрического тока в гидратированном слое являются ионы водорода, а в слое сухого стекла ионы натрия.
Ионы водорода внешней стороны мембраны находятся в равновесии с ионами водорода в исследуемом растворе и на границе раздела возникает потенциал Е1, который определяется активностью ионов водорода во внешнем растворе и на поверхности геля:
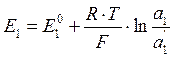
где а1 – активность ионов водорода во внешнем растворе, а´1 – активность ионов водорода в слое геля, контактирующего с внешним раствором.
На поверхности раздела внутреннего раствора и геля происходит перенос ионов водорода от геля в раствор:
Н+ (стекло) ↔ Н+ (раствор)
Потенциал Е2, возникающий на границе внутреннего раствора и геля, определяется активностью ионов водорода во внутреннем растворе (а2) и на соответствующей поверхности геля (а´2):
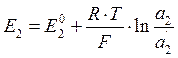
Граничный потенциал мембраны (Ем) стеклянного электрода определяется уравнением:
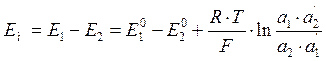
При постоянных значениях а´1 и а´2 уравнение принимает вид:
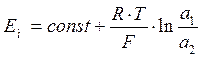 , где
, где
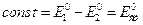
Таким образом, при условии, что поверхности обоих гелей идентичны, потенциал стеклянной мембраны Ем зависит только от активностей ионов водорода в растворах по обе стороны от мембраны. Если активность в одном из растворов а2 поддерживать постоянной, то уравнение имеет вид:
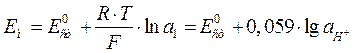
Потенциал мембраны становится мерой активности ионов водорода во внешнем растворе. В величину Е0ст входят величины потенциалов внешнего и внутреннего электродов сравнения, диффузионный потенциал (Едиф) и j-потенциал асимметрии.
Причиной возникновения диффузионного потенциала является различие в подвижностях ионов водорода и ионов щелочных металлов в мембране. Два диффузионных потенциала равны и противоположны по знаку, если поверхности двух гелей идентичны. В этих условиях суммарный диффузионный потенциал равен нулю (Е01 = Е02) и потенциал стеклянного электрода выражается уравнением:
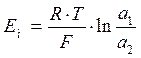
Существование потенциала асимметрии доказано неравенством потенциала электрода нулю при погружении его в раствор, идентичный внутреннему. Причины его появления заключаются в различии структуры и состава внешней и внутренней поверхностей мембраны, возникающего за счет улетучивания некоторых компонентов при изготовлении шарика, механических и химических воздействий, загрязнения внешней поверхности мембраны при эксплуатации электрода. Потенциал асимметрии может достигать величины, соответствующей одной единице рН. В процессе эксплуатации электрода он продолжает изменяться, так как электрод гидратируется, дегидратируется, протравляется, загрязняется компонентами раствора.
Правильные результаты измерения рН можно получить только при регулярной калибровке электрода по стандартным растворам – буферным смесям (таблица 3).
Таблица 3
Буферные смеси, рекомендуемые для градуирования стеклянного электрода
(согласно ГОСТ 8.134-98)
| Состав буферной смеси | рН (250С) |
| Гидротартрат калия (насыщенный раствор) | 3,557 |
| KHC4H4O6 (0,05 М) | 3,776 |
| Гидрофталат калия (0,05 М) | 4,004 |
| KH2PO4+NaHPO4 (0,025 М) | 6,863 |
| KH2PO4 (0,008695 M) + NaH2PO4 (0,0343 M) | 7,415 |
| Na2B4O7 (0,01 M) | 9,183 |
| NaHCO3+Na2CO3 (0,025 M) | 10,014 |
| Ca(OH)2 (насыщенный при 200С раствор) | 12,431 |
При измерении рН со сравнительно невысокой точностью можно использовать один раствор, но для более точных измерений необходимо градуировать электрод по двум растворам. Буферные смеси в таблице 3 характеризуются внутренней согласованностью, то есть электрод, градуированный по раствору с рН=3,557, обязан показать, например, рН=4,004 в растворе бифталата калия.
Стеклянный электрод пригоден для правильного измерения рН в ограниченном интервале рН, зависящем от состава стекла (рис. 8). Предполагается, что неправильные результаты в сильнокислых растворах (кислотная погрешность) обусловлены разрушением стекла.
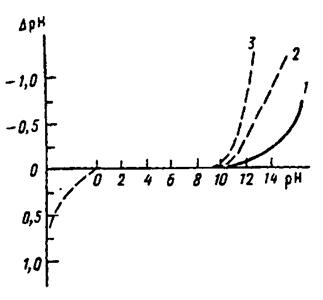
Рис. 8. Погрешности измерения рН стеклянным электродом в зависимости от сорта стекла, из которого изготовлены мембраны:
1 – Бекман Е, 2 – Бекман GP, 3 – Корнинг 015
Знак погрешности измерения рН в щелочных растворах (щелочная погрешность) указывает на то, что электрод реагирует не только на ионы водорода, но и на ионы калия и других щелочных металлов. Все однозарядные ионы вызывают погрешность, величина которой зависит от сорта стекла (КН-М) и природы иона (UM+), что видно из уравнения:
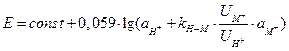
Для хороших электродов 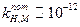 и влияние натрия проявляется при рН=11-12 (при концентрации натрия 1 М погрешность около -0,2 единицы рН).
и влияние натрия проявляется при рН=11-12 (при концентрации натрия 1 М погрешность около -0,2 единицы рН).
Из данного уравнения видно, что, изменяя состав стекла, можно получить мембраны, обладающие пониженной селективностью к ионам водорода и высокой селективностью к ионам М+. Созданы электроды для определения ионов натрия, калия и др.
Двух- и трехзарядные катионы металлов не оказывают мешающего влияния на работу стеклянных электродов, даже если они входят в состав стекла. Подвижность таких ионов в стекле настолько мала, что ей можно пренебречь.
 2015-08-21
2015-08-21 3847
3847








