Е. И. Степановских, Л. А. Брусницына, Т. А. Алексеева
ФИЗИЧЕСКАЯ ХИМИЯ
Примеры решения задач
Министерство образования и науки Российской Федерации
Уральский федеральный университет
имени первого Президента России Б. Н. Ельцина
Утверждаю
Зам.декана ХТИ
________ М.А.Безматерных
ФИЗИЧЕСКАЯ ХИМИЯ
Примеры решения задач
Методические указания для студентов всех специальностей
химико-технологического института
и института материаловедения и металлургии
В двух частях
Часть первая
Рассмотрено на заседании кафедры физической и коллоидной химии
20 сентября 2011 г., протокол № 11
Рассмотрено на заседании методической комиссии химико-технологического института 20 октября 2011 г. протокол № 2
Екатеринбург
УрФУ
УДК 544(076)
Составители: Е. И. Степановских, Л. А. Брусницына, Т. А. Алексеева
Научный редактор доц., канд. хим. наук В. И. Двойнин
Физическая химия. Примеры решения задач:методические указания по курсу физической химии. В 2 ч. Ч.1 / сост. Е. И. Степановских, Л. А. Брусницына, Т. А. Алексеева. Екатеринбург: УрФУ, 2012. 56 с.
Методические указания являются дополнением к имеющимся учебникам и предназначены для самостоятельной работы над курсом физической химии.
Библиогр.: 3 назв. Табл. 9. Рис. 12. Прил. 3.
Подготовлено кафедрой физической и коллоидной химии
© Уральский федеральный
университет, 2012
ОСНОВНЫЕ ОБОЗНАЧЕНИЯ И ПОНЯТИЯ
· Давление (p). Единицы измерения [ p ] = атм; бар; Па.
1 атм = 1,013×105 Па. 1 бар = 1,0×105 Па.
· Объем (V). [ V ] = л; м3; см3.
1 л = 1000 мл = 103 см3 = 10-3 м3; 1 см3 = 1×10-6 м3.
· Температура (Т) в шкале Кельвина. [ T ] = К.
· Температура (t) в шкале Цельсия. [ t ] = оС.
1 К = 273,15 + оС
· Масса (m). [ m ] = кг; г. 1 кг = 1000 г.
· Число молей (n). [ n ] = моль.
· Теплоемкость системы (С). [ C ] = Дж/К.
· Изобарная теплоемкость системы (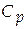 ). [ Cp ] = Дж/К.
). [ Cp ] = Дж/К.
· Изохорная теплоемкость системы (C v). [ C v] = Дж/К.
· Мольная изобарная теплоемкость системы (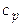 ).
).
[ 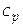 ] = Дж/(К×моль).
] = Дж/(К×моль).
· Мольная изохорная теплоемкость системы (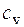 ).
).
[ 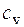 ] = Дж/(К×моль).
] = Дж/(К×моль).
· Удельный объем чистого вещества (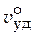 ). [
). [ 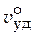 ] = м3/кг.
] = м3/кг.
· Мольный объем чистого вещества (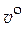 ). [
). [ 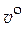 ] = м3/моль.
] = м3/моль.
· Плотность массы чистого вещества (ρо). [ 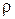 о] = кг/м3.
о] = кг/м3.
· Работа (A).[ A ] = Дж.
· Количество теплоты (Q). [ Q ] = Дж.
· Энтропия (полная, всей системы) (S). [ S ] = Дж/К.
· Мольная энтропия (s). [ s ] = Дж/(моль×К).
· Внутренняя энергия (U). [ U ] = Дж.
· Мольная внутренняя энергия (u). [ u ] = Дж/моль.
· Энтальпия (полная, всей системы) (Н). [ H ] = Дж.
· Мольная энтальпия (h). [ h ] = Дж/моль.
· Энергия Гиббса (G). [ G ] = Дж.
· Мольная энергия Гиббса (g). [ g ] = Дж/моль.
· Мольная доля компонента k (Nk).
· Массовая доля компонента k (φ k).
· Мольный объем (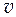 ). [
). [ 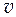 ] = м3/моль.
] = м3/моль.
· Удельный объем (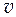 уд). [
уд). [ 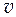 уд] = м3/кг.
уд] = м3/кг.
· Парциальный мольный объем компонента k (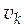 ).
).
[ 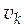 ] = м3/моль.
] = м3/моль.
· Глубина химической реакции (кси) (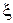 ).
).
· Стехиометрическое число компонента k в реакции (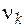 ).
).
· Стандартная мольная энтальпия реакции (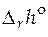 ).
).
· Стандартная мольная энтальпия образования вещества k
(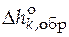 ).
).
· Стандартная мольная энтропия реакции (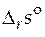 ).
).
· Стандартная мольная энтропия вещества k (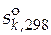 ).
).
· Стандартная мольная изобарная теплоемкость реакции r
(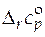 ).
).
· Константа равновесия реакции r в p-шкале (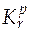 ).
).
· Уравнение состояния идеального газа - системы невзаимодействующих частиц точечного размера;
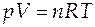 , (А)
, (А)
где n - количество вещества (в молях);
R - универсальная газовая постоянная,
R = 8,314 Дж/(моль×К) = 1,987 кал/(моль×К) = 0,0821 л×атм/(моль×К).
· Нормальные условия - это температура 0 оС и давление 1 атм.
· Первый закон (первое начало) термодинамики:
энергия изолированной системы постоянна −
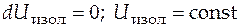 .
.
В неизолированной системе энергия может изменяться за счет:
а) совершения системой работы над окружающей средой;
 2015-09-06
2015-09-06 323
323







