Математическая формулировка первого закона для закрытых систем:
dU = d Q - d A; D U = Q - A. (Б)
Буквы d в уравнении (Б) отражают тот факт, что Q и A не являются функциями состояния, они служат формами передачи энергии и связаны с процессами, а не с состояниями системы. Их называют также функциями перехода и бесконечно малое изменение теплоты и работы не является полным дифференциалом.
Теплота может переходить в систему при нагревании. Для расчета теплоты используют понятие теплоемкости (С)
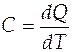 , (В)
, (В)
где 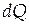 - бесконечно малое количество теплоты, сообщенное системе для изменения ее температуры на
- бесконечно малое количество теплоты, сообщенное системе для изменения ее температуры на 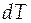 . Теплоемкость - экстенсивное свойство. Теплоемкость зависит от природы вещества, его агрегатного состояния, от температуры. На рисунке показана в общем виде зависимость мольной изобарной теплоемкости вещества от температуры.
. Теплоемкость - экстенсивное свойство. Теплоемкость зависит от природы вещества, его агрегатного состояния, от температуры. На рисунке показана в общем виде зависимость мольной изобарной теплоемкости вещества от температуры.
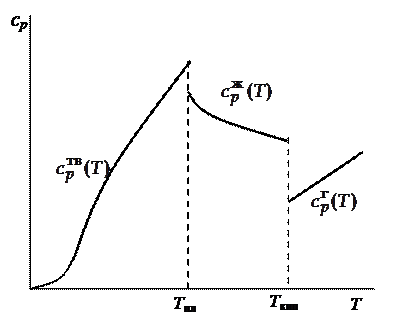
Зависимость изобарной
теплоемкости вещества
от температуры
Эта зависимость получается при подстановке произвольных значений температуры в эмпирически наблюдаемые и приведенные в справочной литературе температурные ряды
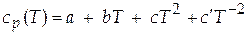 , (Г)
, (Г)
где 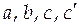 - эмпирические коэффициенты.
- эмпирические коэффициенты.
При температуре системы, меньшей чем температура плавления (Т < Т пл), температурная зависимость теплоемкости вещества 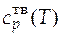 имеет вид
имеет вид
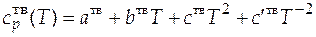 . (Д)
. (Д)
При температуре, находящейся в интервале от температуры плавления до температуры кипения (T пл < Т < Т кип), вещество будет в жидком состоянии и температурная зависимость теплоемкости будет следующей:
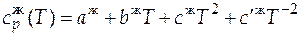 . (Е)
. (Е)
И, наконец, при температуре системы выше температуры кипения вещества (T кип < Т), когда вещество находится в газообразном виде, зависимость теплоемкости от температуры имеет вид:
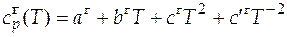 . (Ж)
. (Ж)
Для идеальных газов мольная теплоемкость практически не зависит от температуры и равна:
для одноатомных идеальных газов 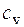 = 3/2 R;
= 3/2 R;
двухатомных идеальных газов 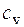 = 5/2 R;
= 5/2 R;
нелинейных трехатомных и многоатомных молекул 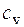 = 3 R.
= 3 R.
Для идеальных газов справедливо уравнение Майера
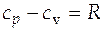 . (И)
. (И)
Экспериментально обнаружено, что внутренняя энергия идеального газа не зависит ни от объема, ни от давления, т.е.
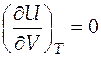 и
и 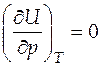 .
.
· Второй закон термодинамики устанавливает критерии необратимости термодинамических процессов: с уществует функция состояния - энтропия S, которая обладает следующим свойством 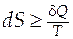 , причем знак равенства относится к обратимым процессам, а знак больше - к необратимым.
, причем знак равенства относится к обратимым процессам, а знак больше - к необратимым.
Для изолированных систем второй закон утверждает, что энтропия изолированных систем в необратимых процессах может только возрастать, а в состоянии термодинамического равновесия она достигает максимума (dS = 0).
В отличие от многих других термодинамических функций, энтропия имеет точку отсчета, которая задается постулатом Планка: при абсолютном нуле T = 0 К все идеальные кристаллы имеют одинаковую энтропию, равную нулю.
 2015-09-06
2015-09-06 1182
1182








