Перепишем формулу (3.17) в виде
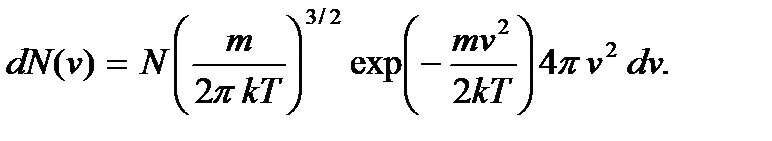 (3.19)
(3.19)
Если ввести воображаемое пространство скоростей (v -пространство), по осям которого откладывать три компоненты vx, vy и vz вектора скорости v, то каждой молекуле, вектор скорости которой имеет компоненты vx, vy, vz, в этом пространстве будет соответствовать точка. А поскольку соотношение
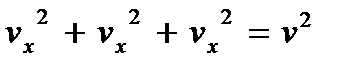 , (3.20)
, (3.20)
связывающее модуль вектора скорости с его компонентами, в v -пространстве представляет собой уравнение сферы радиуса v, то все точки, соответствующие молекулам, модуль скорости которых не превышает значения v, лежат в объеме шара радиуса v, а точки, соответствующие молекулам, скорости которых заключены в интервале от v до v + dv, – в шаровом слое радиуса v и толщины dv. Поэтому величина 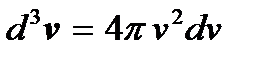 в формуле (3.19) есть объем указанного шарового слоя. Молекулам, компоненты скорости которых лежат в интервалах между vx, vy, vz и vx + dvx, vy + dvy, vz + + dvz, в v -пространстве соответствует элемент объема
в формуле (3.19) есть объем указанного шарового слоя. Молекулам, компоненты скорости которых лежат в интервалах между vx, vy, vz и vx + dvx, vy + dvy, vz + + dvz, в v -пространстве соответствует элемент объема 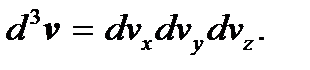 Заменив в формуле (3.19) элемент объема
Заменив в формуле (3.19) элемент объема 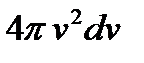 на
на 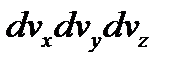 и учтя соотношение (3.20), преобразуем эту формулу к виду, определяющему число молекул газа, компоненты скорости которых лежат в интервалах между vx и vx + dvx, vy и vy + + dvy, vz и vz + dvz:
и учтя соотношение (3.20), преобразуем эту формулу к виду, определяющему число молекул газа, компоненты скорости которых лежат в интервалах между vx и vx + dvx, vy и vy + + dvy, vz и vz + dvz:
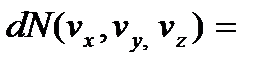
= 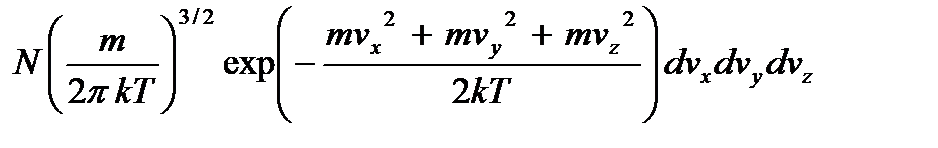 =
=
= 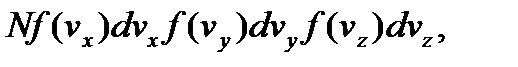
где функции
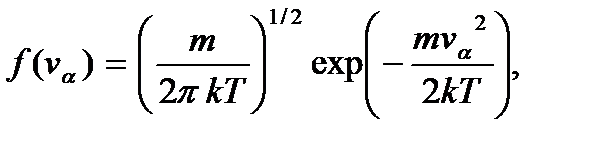 (3.21)
(3.21)
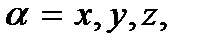 представляют собой функции распределения молекул газа по компонентам скорости vx, vy и vz. Легко убедиться, что эти функции, как и функция (3.18), нормированы на единицу, т.е. что
представляют собой функции распределения молекул газа по компонентам скорости vx, vy и vz. Легко убедиться, что эти функции, как и функция (3.18), нормированы на единицу, т.е. что 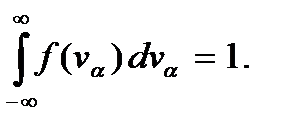 Вид этих функций представлен на рис. 3.5 для двух температур. Они являются четными и положительными, поэтому симметричны относительно оси ординат; принимают максимальное значение при
Вид этих функций представлен на рис. 3.5 для двух температур. Они являются четными и положительными, поэтому симметричны относительно оси ординат; принимают максимальное значение при 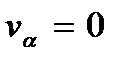 и стремятся к нулю, когда
и стремятся к нулю, когда 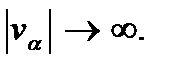 Более пологая кривая отвечает более высокой температуре. Это означает, что чем выше температура, тем больше вероятность найти молекулу с большим значением скорости. Наоборот, меньшие скорости вероятнее при низких температурах.
Более пологая кривая отвечает более высокой температуре. Это означает, что чем выше температура, тем больше вероятность найти молекулу с большим значением скорости. Наоборот, меньшие скорости вероятнее при низких температурах.
Функции 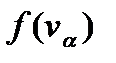 имеют вид нормального закона Гаусса распределения случайных величин
имеют вид нормального закона Гаусса распределения случайных величин 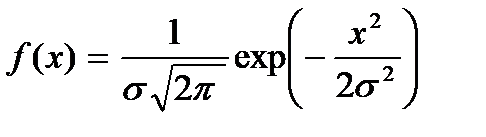 со средним значением
со средним значением 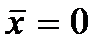 и средним квадратичным отклонением
и средним квадратичным отклонением
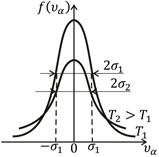 Рис. 3.5
Рис. 3.5
|
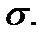 Следовательно, компонента скорости молекулы есть случайная величина, распределенная по нормальному закону Гаусса. Величина
Следовательно, компонента скорости молекулы есть случайная величина, распределенная по нормальному закону Гаусса. Величина  определяет среднее квадратичное отклонение компоненты скорости
определяет среднее квадратичное отклонение компоненты скорости 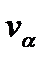 молекулы от ее среднего значения
молекулы от ее среднего значения 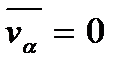 и равна
и равна
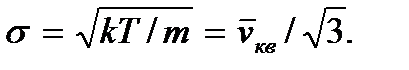
Этот параметр характеризует ширину кривой распределения молекул газа по компоненте скорости (на 0,6 ее высоты, так как
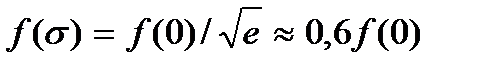 ),
),
величину естественного разброса компоненты скорости молекулы относительно среднего значения и, как видим, определяется температурой газа Т. С ростом температуры этот разброс увеличивается. Площадь между прямыми 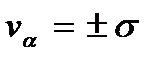 равна
равна 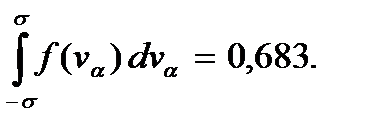 Это означает, что
Это означает, что 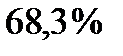 всех молекул газа имеют компоненты скорости в интервале между
всех молекул газа имеют компоненты скорости в интервале между  В промежутке
В промежутке 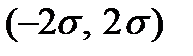 имеют компоненты скорости
имеют компоненты скорости 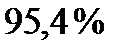 , а в промежутке
, а в промежутке 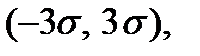 соответственно,
соответственно, 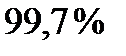 всех молекул газа.
всех молекул газа.
 2015-09-06
2015-09-06 412
412








