Теплова (середньоквадратична) швидкість 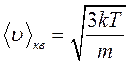 являє собою деяку середню характеристику теплового руху всієї сукупності мікрочастинок. Насправді різні частинки рухаються з різними швидкостями, й можна порушити питання про розподіл мікрочастинок за швидкостями. Максвелл теоретично вирішив задачу про розподіл молекул ідеального газу за швидкостями поступального руху в стані теплової рівноваги. Він показав, що ймовірність того, що деяке число молекул
являє собою деяку середню характеристику теплового руху всієї сукупності мікрочастинок. Насправді різні частинки рухаються з різними швидкостями, й можна порушити питання про розподіл мікрочастинок за швидкостями. Максвелл теоретично вирішив задачу про розподіл молекул ідеального газу за швидкостями поступального руху в стані теплової рівноваги. Він показав, що ймовірність того, що деяке число молекул 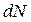 із загального числа молекул
із загального числа молекул 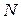 має швидкості, що лежать в інтервалі від
має швидкості, що лежать в інтервалі від 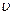 до
до 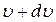 , виражається співвідношенням:
, виражається співвідношенням:
(6.12)
де 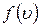 – функція розподілу молекул за швидкостями; a
– функція розподілу молекул за швидкостями; a 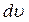 – розглянутий інтервал швидкостей.
– розглянутий інтервал швидкостей.
Вид функції 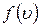 можна встановити на прикладі руху молекул ідеального газу в однорідному полі тяжіння. Спочатку вивчимо закон розподілу молекул за значеннями вертикальної складової швидкості
можна встановити на прикладі руху молекул ідеального газу в однорідному полі тяжіння. Спочатку вивчимо закон розподілу молекул за значеннями вертикальної складової швидкості 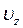 . Число молекул зі швидкостями в інтервалі
. Число молекул зі швидкостями в інтервалі 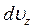 , що перебувають у нескінченно тонкому (товщини
, що перебувають у нескінченно тонкому (товщини 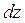 ) шарі газу на висоті
) шарі газу на висоті 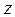 (див. рис 6.2), дорівнює:
(див. рис 6.2), дорівнює:
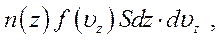 |
де  – концентрація молекул газу на висоті
– концентрація молекул газу на висоті 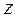 .
.
Рухаючись як вільні, ці молекули із часом перейдуть на деяку висоту 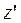 , зайнявши шар товщини
, зайнявши шар товщини 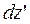 . При цьому їхні швидкості будуть перебувати в інтервалі від
. При цьому їхні швидкості будуть перебувати в інтервалі від 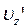 до
до 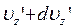 . Але це одне й те саме число молекул. Якщо прийняти, що
. Але це одне й те саме число молекул. Якщо прийняти, що 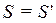 , то незмінність числа цих молекул повинна виражатися рівністю:
, то незмінність числа цих молекул повинна виражатися рівністю:
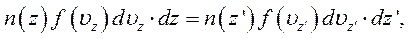

(6.13)
де 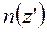 – концентрація молекул газу на висоті
– концентрація молекул газу на висоті 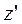 . При русі у полі тяжіння горизонтальні складові швидкості (
. При русі у полі тяжіння горизонтальні складові швидкості (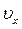 і
і 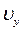 ) не змінюються, а зміна
) не змінюються, а зміна 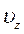 визначається законом збереження енергії, відповідно до якого:
визначається законом збереження енергії, відповідно до якого:
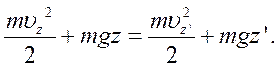 |
(6.14)
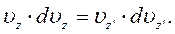 Диференціюючи цю рівність при обраних постійних значеннях
Диференціюючи цю рівність при обраних постійних значеннях 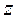 та
та 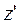 , одержуємо:
, одержуємо:
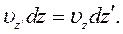 За час
За час 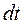 молекула на висоті
молекула на висоті 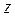 пройде шлях
пройде шлях 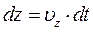 , а на висоті
, а на висоті 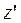 – шлях
– шлях 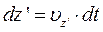 . Виключивши звідси
. Виключивши звідси 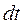 , одержимо:
, одержимо:
(6.15)
Перемноживши почленно рівняння (6.14) і (6.15), знаходимо:
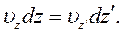 |
З урахуванням останнього рівняння (6.13) спрощується:
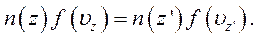 |
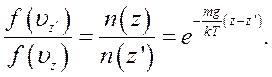 Використавши закон розподілу Больцмана у вигляді рівняння (6.7), одержимо:
Використавши закон розподілу Больцмана у вигляді рівняння (6.7), одержимо:
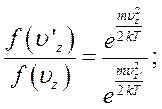 |
На основі закону збереження й перетворення енергій знаходимо:
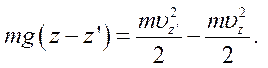 |
Тоді:
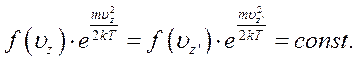 |
Звідси випливає, що:
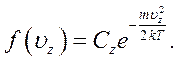 |
(6.16)
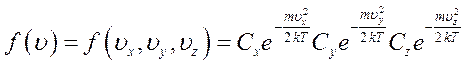 У стані теплової рівноваги рух молекул газу рівноймовірний у всіх напрямках. Оскільки ймовірність складної події, що складається із простих незалежних подій, дорівнює добутку ймовірностей цих подій, то повна функція розподілу молекул за швидкостями буде мати вигляд:
У стані теплової рівноваги рух молекул газу рівноймовірний у всіх напрямках. Оскільки ймовірність складної події, що складається із простих незалежних подій, дорівнює добутку ймовірностей цих подій, то повна функція розподілу молекул за швидкостями буде мати вигляд:
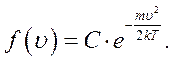 Позначивши
Позначивши 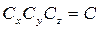 и прийнявши, що
и прийнявши, що 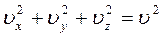 одержимо:
одержимо:
(6.17)
На підставі рівнянь (6.12) та (6.17) отримаємо:
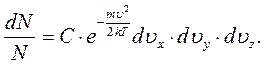 |
(6.18)
Добуток 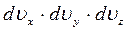 являє собою об'єм нескінченно малого паралелепіпеда, побудованого в координатній системі простору швидкостей навколо точки з векторною координатою
являє собою об'єм нескінченно малого паралелепіпеда, побудованого в координатній системі простору швидкостей навколо точки з векторною координатою 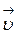 . Оскільки тепловий рух молекул газу рівноймовірний у всіх напрямках, то для обчислення
. Оскільки тепловий рух молекул газу рівноймовірний у всіх напрямках, то для обчислення 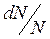 необхідно просумувати всі такі елементарні об'єми, що перебувають на відстані
необхідно просумувати всі такі елементарні об'єми, що перебувають на відстані 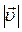 . Ці об'єми заповнять кульовий шар між двома нескінченно близькими сферами з радіусами
. Ці об'єми заповнять кульовий шар між двома нескінченно близькими сферами з радіусами 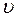 та
та 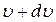 . Об'єм такого шару дорівнює
. Об'єм такого шару дорівнює 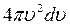 . Таким чином, число молекул
. Таким чином, число молекул 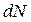 зі швидкостями в інтервалі значень між
зі швидкостями в інтервалі значень між 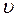 та
та 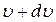 дорівнює:
дорівнює:
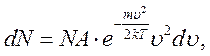 (6.19)
(6.19)
де 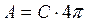 – деяка постійна, що не залежить від швидкості молекул. Знайдемо вираження для цієї величини
– деяка постійна, що не залежить від швидкості молекул. Знайдемо вираження для цієї величини 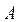 . Оскільки в інтервал швидкостей від 0 до
. Оскільки в інтервал швидкостей від 0 до 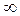 ввійдуть всі молекули, то очевидно, що
ввійдуть всі молекули, то очевидно, що 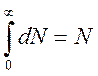 ,
, 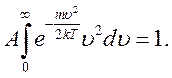
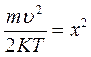 Зробивши заміну змінних та скориставшись значенням
Зробивши заміну змінних та скориставшись значенням
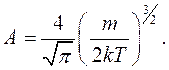 | |||
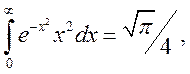 | |||
знайдемо:
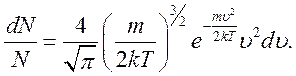 З урахуванням цього закон розподілу Максвелла можна записати у вигляді:
З урахуванням цього закон розподілу Максвелла можна записати у вигляді:
(6.20)
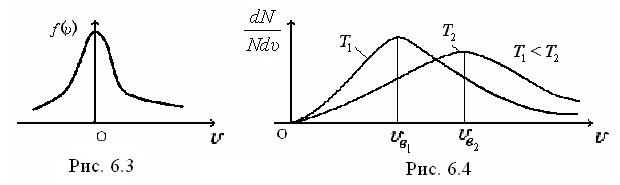
Графік функції (6.20) збігається з гауссовою кривою розподілу випадкової велиини (рис. 6.3), а щільність імовірності розподілу молекул за швидкостями представлена на рис. 6.4.
Як видно з рис. 6.4, при кожній температурі є деяка швидкість 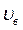 , за якої щільність ймовірності максимальна. Цю швидкість називають найбільш імовірною. Дослідивши рівняння (6.19) на екстремум, одержимо:
, за якої щільність ймовірності максимальна. Цю швидкість називають найбільш імовірною. Дослідивши рівняння (6.19) на екстремум, одержимо:
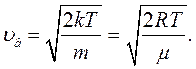 (6.21)
(6.21)
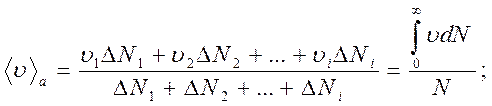
Скориставшись законом розподілу Максвелла, знайдемо середньоарифметичну швидкість молекул:
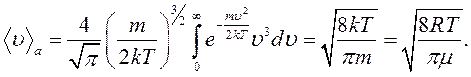 |
Таким чином, стан газу можна охарактеризувати однієї із трьох швидкостей:
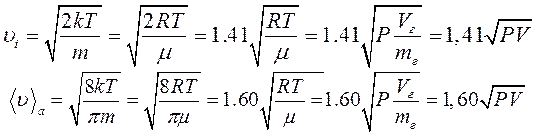 | |||
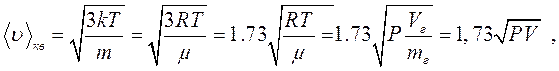 |
де 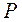 ,
, 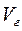 та
та 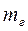 – тиск, об'єм і маса газу,
– тиск, об'єм і маса газу, 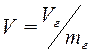 – питомий об'єм газу.
– питомий об'єм газу.
Співвідношення між швидкостями має такий вигляд: 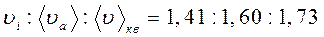
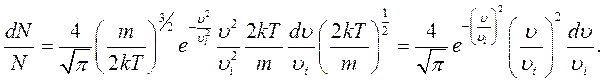 Скориставшись рівнянням (6.21), закон розподілу Максвелла (6.20) можна подати через вірогідну швидкість:
Скориставшись рівнянням (6.21), закон розподілу Максвелла (6.20) можна подати через вірогідну швидкість:
Подібно до розподілу Больцмана, розподіл Максвелла, виведений тут для одноатомного ідеального газу, може бути отриманий шляхом більш загальних теоретичних міркувань і має універсальний характер. Однак він отриманий на підставі класичної механіки, і його справедливість обмежена квантовими явищами.
Закон розподілу Максвелла підтверджується різними експериментальними методами, з якими студенти можуть ознайомитися у зазначеному раніше навчальному посібнику [1].
 2015-09-06
2015-09-06 574
574








