Бензол
Простейшей ароматической молекулой является молекула бензола С6Н6. При рассмотрении ее молекулярных орбиталей (см. п. 6.2.3) мы пришли к выводу, что нижней заполненной молекулярной орбиталью является орбиталь симметрии 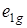 . При поглощении кванта света электрон переходит из занятой молекулярной орбитали типа
. При поглощении кванта света электрон переходит из занятой молекулярной орбитали типа 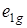 на свободную симметрии
на свободную симметрии 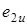 , т. е. симметрия результирующего состояния есть
, т. е. симметрия результирующего состояния есть
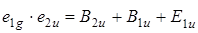 .
.
Таким образом, первое электронное возбужденное состояние дает три состояния, которые соответствуют случайному вырождению. Учет межэлектронного отталкивания приводит к трем отдельным состояниям, которые располагаются в следующем порядке: B 2 u , B 1 u , E 1 u Действительно, сопоставление с экспериментом показывает,что в ультрафиолетовой области спектра бензол имеет три полосы поглощения, причем две из них обладают колебательной структурой со сравнительно малой силой осциллятора (запрещенные переходы 260 и 200 нм) и одна характеризуется высокой силой осциллятора при 180 нм, равной единице. Общая схема электронных переходов показана на рис. 6.18.
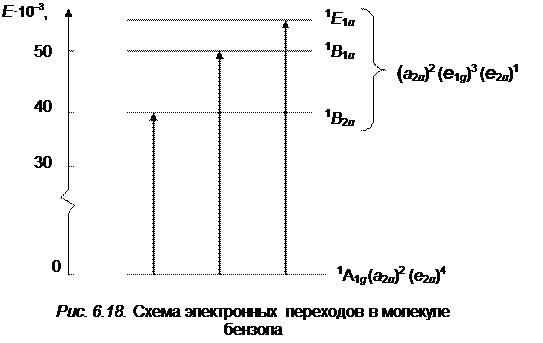 Первый длинноволновый переход соответствует электронному переходу типа
Первый длинноволновый переход соответствует электронному переходу типа 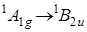 , который для точечной группы симметрии D 6 h молекулы бензола запрещен по симметрии. Разрешается он при учете взаимодействий электронного и колебательного движения (эффект Герцберга – Теллера, см. 6.42). Колебание e 2 g вследствие вибронного взаимодействия смешивает состояния
, который для точечной группы симметрии D 6 h молекулы бензола запрещен по симметрии. Разрешается он при учете взаимодействий электронного и колебательного движения (эффект Герцберга – Теллера, см. 6.42). Колебание e 2 g вследствие вибронного взаимодействия смешивает состояния 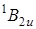 и
и 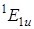 . Действительно, если рассмотреть прямое произведение типа симметрии электронного состояния
. Действительно, если рассмотреть прямое произведение типа симметрии электронного состояния 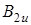 на колебательное состояние
на колебательное состояние 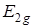 , то получится тип симметрии вибронного состояния
, то получится тип симметрии вибронного состояния 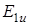 , которое хорошо взаимодействует с разрешенным состоянием
, которое хорошо взаимодействует с разрешенным состоянием 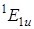 в силу одинаковой симметрии.
в силу одинаковой симметрии.
В молекуле бензола имеется четыре колебания типа 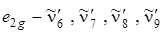 (см. табл. 6.1).
(см. табл. 6.1).
Таблица 6.1
Колебательные частоты (см–1) молекулы бензола в парах.
Нижнее электронное состояние 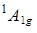 и верхнее
и верхнее 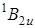
| Обозначение частот | Симметрия | Состояния | |
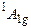 , , 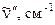 | 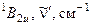 | ||
| n~1 | a 1 g | 923 * | |
| n~2 | a 1 g | ||
| n~3 | a 2 g | ||
| n~4 | b 2 g | ||
| n~5 | b 2 g | ||
| n~6 | e 2 g | 521* | |
| n~7 | e 2 g | ||
| n~8 | e 2 g | ||
| n~9 | e 2 g | ||
| n~10 | e 1 g | ||
| n~11 | a 2 u | ||
| n~12 | b 1 u | ||
| n~13 | b 1 u | ||
| n~14 | b 2 u | ||
| n~15 | b 2 u | ||
| n~16 | e 1 g | ||
| n~17 | e 1 g | ||
| n~18 | e 1 u | ||
| n~19 | e 1 u | ||
| n~20 | e 1 u |
* – обозначены наиболее интенсивные вибронные переходы в спектре электронного поглощения (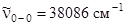 ).
).
Нумерация частот приведена по Вильсону. Два штриха у частоты обозначает нижнее электронное состояние. Самые интенсивные в спектре поглощения полосы соответствуют переходам, включающим однократное колебание 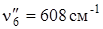 с последующей комбинацией его с полносимметричным колебанием
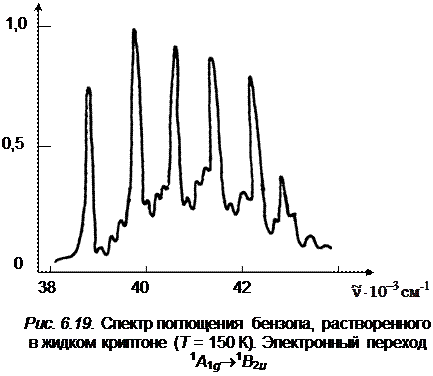
с последующей комбинацией его с полносимметричным колебанием 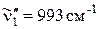 (дыхательное колебание кольца). В качестве примера на рис.6.19 приведен спектр поглощения бензола, растворенного в жидком криптоне (T = 150 К, длинноволновая область).
(дыхательное колебание кольца). В качестве примера на рис.6.19 приведен спектр поглощения бензола, растворенного в жидком криптоне (T = 150 К, длинноволновая область).
 |
Почти 95 % всей интенсивности сосредоточено именно в вибронных компонентах указанных колебаний. Около 5 % спектра поглощения приходится на другие комбинации частот типа симметрии e 2 g. На рис. 6.20 приведено схематическое изображение спектра поглощения бензола в парах.
Кроме того, в спектре поглощения паров ряд наблюдается горячих переходов с включением колебаний 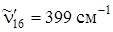 ,
, 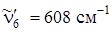 и
и  в нижнем электронном состоянии. На рис. 6.20 горячие полосы не указаны, чтобы не загромождать рисунок. Отмечены только наиболее интенсивные серии и несколько слабых. В литературе условились обозначать серии следующим образом: серия
в нижнем электронном состоянии. На рис. 6.20 горячие полосы не указаны, чтобы не загромождать рисунок. Отмечены только наиболее интенсивные серии и несколько слабых. В литературе условились обозначать серии следующим образом: серия 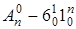 , серия
, серия 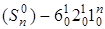 , серия
, серия 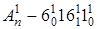 (горячая серия), а также отдельная серия
(горячая серия), а также отдельная серия 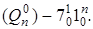
Обозначения следует читать следующим образом: цифра обозначает номер колебания по Вильсону; верхний индекс – значение колебательного квантового числа в верхнем электронном состоянии; нижний индекс – то же самое для нижнего состояния.

Например, 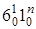 – означает колебание n~ ' 6и комбинация с ним колебания n~ ' 1в верхнем со стоянии (правда, оно может комбинировать n раз). Частоты этой серии определяются как
– означает колебание n~ ' 6и комбинация с ним колебания n~ ' 1в верхнем со стоянии (правда, оно может комбинировать n раз). Частоты этой серии определяются как 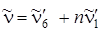 . В спектре поглощения мы наблюдаем прогрессии по частоте
. В спектре поглощения мы наблюдаем прогрессии по частоте 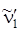 до семи квантов с уменьшающейся частотой от 923см–1 до 917см–1. колебание n~ '' 2(3056см–1, тип e 2 g) также появляется по механизму Герцберга – Теллера и дает повторы
до семи квантов с уменьшающейся частотой от 923см–1 до 917см–1. колебание n~ '' 2(3056см–1, тип e 2 g) также появляется по механизму Герцберга – Теллера и дает повторы
с колебанием n~ '' 1(993см–1, тип 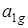 ) до четырех квантов, т. е. соответствующие линии в спектре будут записываться так:
) до четырех квантов, т. е. соответствующие линии в спектре будут записываться так: 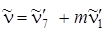 , где
, где
m = 1, 2,..., 4.
Частота e 2 g, равная 1178см–1 проявляется в комбинации с частотой n~ ' 6 (525 см–1), а затем в комбинации с полносимметричным колебанием (923 см–1). В газовой фазе переход 0–0 запрещен, однако в растворе бензола в криптоне он очень слабо разрешен. Общий вид спектра поглощения бензола в жидком криптоне очень похож на спектр поглощения в
газовой фазе и для наглядности он приведен на рис. 6.19 (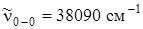 ).На схеме рис. 6.20 многие серии полос представлены условно.
).На схеме рис. 6.20 многие серии полос представлены условно.
В табл 6.1 приведены частоты колебаний, зарегистрированные в нижнем и верхнем электронных состояниях. Как следует из таблицы, некоторые частоты испытывают заметные изменения своих значений, особенно в сторону уменьшения. Правда, существует несколько колебаний, которые увеличивают свои частоты при возбуждении молекулы. Таким образом, в электронном спектре поглощения всегда выделяются две-три частоты колебаний, которые в общем формируют весь электронно-колебательный спектр молекулы. Их интенсивность в спектре определяется спецификой электронно-колебательного взаимодействия. Это положение относится и к другим ароматическим молекулам.
6.6.2 Нафталин
Молекула нафталина С10Н8 содержит два бензольных кольца и относится к точечной группе симметрии D 2 h . Если провести аналогию между спектром поглощения паров нафталина (рис. 6. 21) и бензола, то следует заметить, что чисто электронный переход в спектре нафталина значительно смещен в красную сторону по сравнению со спектром бензола (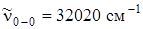 ). Экспериментальные данные по поляризации показывают, что первый электронный переход в молекуле нафталина относится к типу B 3 u и разрешен по симметрии. Однако экспериментально измеренная сила осциллятора этого перехода
). Экспериментальные данные по поляризации показывают, что первый электронный переход в молекуле нафталина относится к типу B 3 u и разрешен по симметрии. Однако экспериментально измеренная сила осциллятора этого перехода 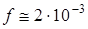 почти в 50 раз меньше перехода в следующее электронное состояние
почти в 50 раз меньше перехода в следующее электронное состояние 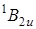 и на три порядка меньше в третье возбужденное состояние
и на три порядка меньше в третье возбужденное состояние 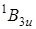 . Квантовомеханический расчет силы осциллятора первого синглет-синглетного перехода
. Квантовомеханический расчет силы осциллятора первого синглет-синглетного перехода 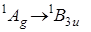 в p- электронном приближении дает нулевой результат, что можно объяснить «случайной» симметрией волновых функций.
в p- электронном приближении дает нулевой результат, что можно объяснить «случайной» симметрией волновых функций.
Поэтому можно предположить, что общая структура спектра поглощения будет подобна структуре спектра молекулы бензола. На рис. 6.21 приведена схема спектра поглощения паров нафталина.

При сравнении спектров поглощения паров бензола и нафталина можно установить, что наиболее интенсивные вибронные переходы в молекуле нафталина начинаются из двух несимметричных колебаний типа b 1 g и включают частоты 438 и 911 см–1 (см. рис. 6.21 и табл. 6.2). Колебания, которые смешивают оба состояния (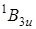 и
и 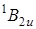 ), должны относиться к типу симметрии b 1 g .
), должны относиться к типу симметрии b 1 g .
Таблица 6.2
Колебательные частоты (см–1) в спектрах поглощения
и флуоресценции паров нафталина
Флуоресценция 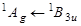 | Поглощение 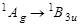 | Обозначения частот и симметрия колебаний |
| n~17(b 1 g ) | ||
| n~9(ag) | ||
| n~8 (ag) | ||
| n~16 (b 1 g ) | ||
| n~7(ag) | ||
| n~6(ag) или n~17+2n~8(b 1 g ) | ||
| n~5(ag) | ||
| n~17+n~7(b 1 g ) | ||
| n~4(ag) | ||
| n~12(b 1 g ) | ||
| n~17+2n~8(b 1 g ) | ||
| n~17+n~13 |
Действительно, согласно теории групп вибронный переход, соответствующий колебанию типа b 1 g , будет иметь симметрию B 2 u , т. е. 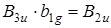 , поэтому он будет хорошо взаимодействовать с электроном перехода той же симметрии и заимствовать из него свою интенсивность.
, поэтому он будет хорошо взаимодействовать с электроном перехода той же симметрии и заимствовать из него свою интенсивность.
В спектре наблюдаются наиболее интенсивные переходы с включением двух колебаний типа b 1 g (438 и 911см–1), которые и дают существенный вклад в общую интенсивность спектра поглощения, поэтому часть вибронных линий почти не уменьшает свою интенсивность при приближении к частоте второго чисто электронного перехода (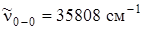 ). Поляризация этих переходов отличается от поляризации чисто электронного перехода (
). Поляризация этих переходов отличается от поляризации чисто электронного перехода ( ) и его повторений с частотами полносимметричных колебаний. Таких колебаний в ближней области спектра поглощения можно обнаружить до четырех (501, 702, 987 и 1382 см–1).
) и его повторений с частотами полносимметричных колебаний. Таких колебаний в ближней области спектра поглощения можно обнаружить до четырех (501, 702, 987 и 1382 см–1).

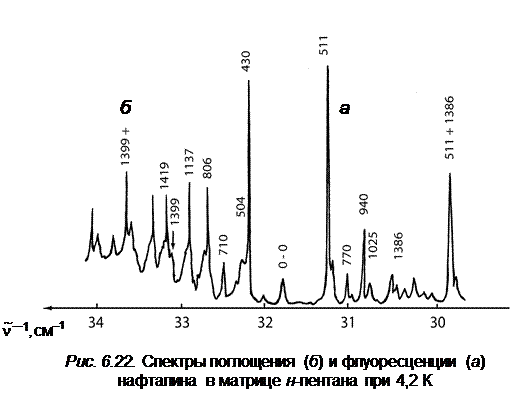
В спектроскопии полагают, что первый чисто электронный переход проявляется в спектре поглощения за счет эффекта Герцберга – Теллера. А так как в спектре поглощения чисто электронный переход все-таки наблюдается, хотя и с малой интенсивностью, то, согласно принципу Франка – Кондона, в комбинации с ним можно обнаружить указанные выше колебания полносимметричного типа, которые в спектрах поглощения и флуоресценции будут давать серии линий (секвенции, т. е. повторы по частоте одного или нескольких активных полносимметричных колебаний). На рис. 6.22 в качестве иллюстрации приведены начальные участки спектров поглощения и флуоресценции нафталина в матрице n- пентана при 4,2 К. Линия 0–0-перехода совмещена.
Из рис. 6.22 видно, что сохраняется зеркальная симметрия спектров и наиболее активно проявляются в обоих спектрах одни и те же колебания. В спектре флуоресценции хорошо заметно начало повтора структуры спектра на частоте полносимметричного колебания (1380 см–1.)
6.6.3 Антрацен
Молекула антрацена С  Н
Н 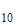 содержит три бензольных кольца и, подобно бензолу и нафталину имеет плоское строение и относится к точечной группе симметрии D
содержит три бензольных кольца и, подобно бензолу и нафталину имеет плоское строение и относится к точечной группе симметрии D 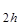 . Чисто электронный переход в молекуле разрешен и имеет заметную силу осциллятора порядка
. Чисто электронный переход в молекуле разрешен и имеет заметную силу осциллятора порядка 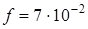 . Согласно принципу Франка-Кондона в электронном спектре поглощения преимущественно будут проявляться полносимметричные колебания молекулы, взаимодействующие с чисто электронным переходом. Действительно, для молекулы антрацена можно выделить таких два колебания с частотами
. Согласно принципу Франка-Кондона в электронном спектре поглощения преимущественно будут проявляться полносимметричные колебания молекулы, взаимодействующие с чисто электронным переходом. Действительно, для молекулы антрацена можно выделить таких два колебания с частотами 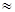 400 см–1 (деформационное колебание, приводящее к изменению скелета молекулы) и 1400 см–1, возбуждение которого сопровождается изменением размеров короткой оси молекулы. Отметим при этом, что вдоль этой же оси поляризован рассматриваемый электронный переход. На рис. 6.23 приведен пример поглощения 9-метилантрацена в парах при сравнительно высокой температуре.
400 см–1 (деформационное колебание, приводящее к изменению скелета молекулы) и 1400 см–1, возбуждение которого сопровождается изменением размеров короткой оси молекулы. Отметим при этом, что вдоль этой же оси поляризован рассматриваемый электронный переход. На рис. 6.23 приведен пример поглощения 9-метилантрацена в парах при сравнительно высокой температуре.
Из рисунка можно четко выделить два колебания – низкочастотное, дающее перегиб в области первой полосы, и высокочастотное, которое ответственно за расширение спектра в коротковолновую сторону. Последнее колебание дает повторы, которых можно наблюдать до пяти. Конечно, изучая тонкоструктурные спектры молекулы, можно обнаружить и ряд других, достаточно слабых колебаний, присутствующих в спектре поглощения 1506, 1585, 1640 см‑1. На рис. 6.24 приведен спектр возбуждения (поглощения) молекулы антрацена, охлажденного в сверхзвуковой струе. В спектре заметны как низкочастотные так и высокочастотные колебания. Особо следует отметить основную несущую частоту 1380 см–1(ag), которая в спектре дает повторы до пяти квантов. Отметим, что низкочастотное колебание 387 см–1, заметно в спектре только двумя квантами.

В табл 6.3 приведены значения и симметрия частот молекулы антрацена, наблюдаемых в низкотемпературных тонкоструктурных спектрах.
Таблица 6.3.
Колебательные частоты (в см–1) в спектрах поглощения и флуоресценции
молекулы антрацена
Поглощение, пары 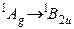 | Флуоресценция, пары 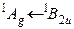 | Поглощение в матрице | Расчет | Отнесение колебаний |
| n~12, аg | ||||
| n~11, аg | ||||
| n~24, b 3 g | ||||
| n~9, аg | ||||
| n~8, аg | ||||
| n~7, аg | ||||
| n~6, аg | ||||
| n~5, аg | ||||
| n~16, b 1 g | ||||
| n~15, b 1 g |
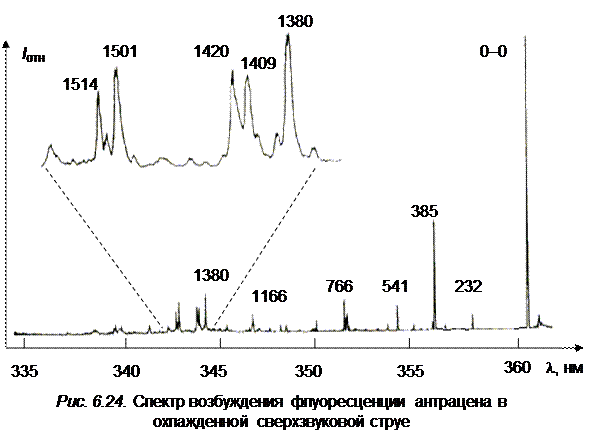
Анализ спектров показывает, что только две частоты полносимметричных колебаний типа ag 390 и 1400 см–1 определяют всю структуру спектра как поглощения, так и флуоресценции. Первую частоту можно проследить до двух, а вторую до пяти квантов. Они и определяют все секвенции (повторы) в спектрах (см. рис. 6.23).
6.7. Спектроскопия молекул в
конденсированной среде
 2015-09-06
2015-09-06 1740
1740
