Сокращенно метод молекулярных орбиталей (МО) в литературе получил название как метод линейной комбинации атомных орбиталей (ЛКАО). Молекула рассматривается как целое, а не как совокупность сохраняющих свою индивидуальность атомов. Каждый электрон принадлежит всей молекуле в целом и движется в поле всех ее ядер и других электронов.
Состояние электрона в молекуле описывается одноэлектронной волновой функцией  i (i означает i -й электрон). Эта функция называется молекулярной орбиталью (МО) и характеризуется определенным набором квантовых чисел. Находится она в результате решения уравнения Шредингера для молекулярной системы с одним электроном. В отличие от одноцентровой атомной орбитали (АО) молекулярная орбиталь всегда многоцентровая, так как число ядер в молекуле не менее двух. Как и для электрона в атоме, квадрат модуля волновой функции |
i (i означает i -й электрон). Эта функция называется молекулярной орбиталью (МО) и характеризуется определенным набором квантовых чисел. Находится она в результате решения уравнения Шредингера для молекулярной системы с одним электроном. В отличие от одноцентровой атомной орбитали (АО) молекулярная орбиталь всегда многоцентровая, так как число ядер в молекуле не менее двух. Как и для электрона в атоме, квадрат модуля волновой функции |  i| 2 определяет плотность вероятности нахождения электрона или плотность электронного облака. Каждая молекулярная орбиталь
i| 2 определяет плотность вероятности нахождения электрона или плотность электронного облака. Каждая молекулярная орбиталь  i характеризуется определенным значением энергии Еi. Ее можно определить, зная потенциал ионизации данной орбитали. Электронная конфигурация молекулы (ее нижнее невозбужденное состояние) задается совокупностью МО, занятых электронами. Заполнение молекулярных орбиталей электронами основывается на двух основных положениях. Электрон в молекуле занимает свободную орбиталь с наименьшей энергией, и на одной МО не может находиться более двух электронов с антипараллельными спинами (принцип Паули). Если молекула содержит 2 n электронов, то для описания ее электронной конфигурации требуется n молекулярных орбиталей. Правда, на практике часто рассматривают меньшее число МО, пользуясь понятием валентных электронов, т. е. тех электронов, которые вступают в химическую связь.
i характеризуется определенным значением энергии Еi. Ее можно определить, зная потенциал ионизации данной орбитали. Электронная конфигурация молекулы (ее нижнее невозбужденное состояние) задается совокупностью МО, занятых электронами. Заполнение молекулярных орбиталей электронами основывается на двух основных положениях. Электрон в молекуле занимает свободную орбиталь с наименьшей энергией, и на одной МО не может находиться более двух электронов с антипараллельными спинами (принцип Паули). Если молекула содержит 2 n электронов, то для описания ее электронной конфигурации требуется n молекулярных орбиталей. Правда, на практике часто рассматривают меньшее число МО, пользуясь понятием валентных электронов, т. е. тех электронов, которые вступают в химическую связь.
При переходе одного электрона молекулы с занятой МО на более высокую свободную МО молекула в целом переходит из основного состояния (Ψ) в возбужденное состояние ( *). Для молекулы существует определенный набор разрешенных состояний, которым отвечают определенные значения энергии. Переходы между этими состояниями с поглощением и испусканием света порождают электронный спектр молекулы.
*). Для молекулы существует определенный набор разрешенных состояний, которым отвечают определенные значения энергии. Переходы между этими состояниями с поглощением и испусканием света порождают электронный спектр молекулы.
Для нахождения энергетического спектра молекулы необходимо решить уравнение Шредингера вида
Ĥ  = Е
= Е  , (5.15)
, (5.15)
если известна молекулярная волновая функция  . Однако трудность решения уравнения (5.35) заключается в том, что зачастую
. Однако трудность решения уравнения (5.35) заключается в том, что зачастую  нам не известна. Поэтому одна из главных задач квантовой механики – это нахождение молекулярной волновой функции. Наиболее распространенный способ записи молекулярной орбитали состоит в использовании определенного набора атомных орбиталей, полученных для составляющих молекулу атомов. Если молекулярную орбиталь обозначить как
нам не известна. Поэтому одна из главных задач квантовой механики – это нахождение молекулярной волновой функции. Наиболее распространенный способ записи молекулярной орбитали состоит в использовании определенного набора атомных орбиталей, полученных для составляющих молекулу атомов. Если молекулярную орбиталь обозначить как  i, а атомную – через φ k, то общее соотношение для МО имеет вид
i, а атомную – через φ k, то общее соотношение для МО имеет вид
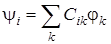 , (5.16)
, (5.16)
т. е. МО есть линейная комбинация атомных орбиталей φ k со своими коэффициентами Cik. Число независимых решений для  i равно числу φ k в исходном базисе. чтобы сократить число атомных волновых, функций выбирают только такие АО, которые дают вклад в химическую связь. Свойства симметрии МО могут быть определены из знаков и числовых значений коэффициентов Cik (коэффициентов ЛКАО) и свойств симметрии атомных орбиталей. Заполнение молекулярных орбиталей электронами проводится по аналогии с атомными. Наиболее точные расчеты для молекул выполняются методом самосогласованного поля (ССП). Молекулярные орбитали, вычисленные методом ССП, наиболее близки к истинным и называются хартри – фоковскими орбиталями.
i равно числу φ k в исходном базисе. чтобы сократить число атомных волновых, функций выбирают только такие АО, которые дают вклад в химическую связь. Свойства симметрии МО могут быть определены из знаков и числовых значений коэффициентов Cik (коэффициентов ЛКАО) и свойств симметрии атомных орбиталей. Заполнение молекулярных орбиталей электронами проводится по аналогии с атомными. Наиболее точные расчеты для молекул выполняются методом самосогласованного поля (ССП). Молекулярные орбитали, вычисленные методом ССП, наиболее близки к истинным и называются хартри – фоковскими орбиталями.
5.3.3 Применение метода молекулярных орбиталей
для описания химической связи в ионе H2+
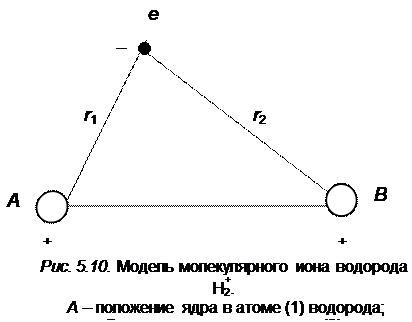
Самой простейшей двухатомной молекулой является молекула водорода H2, химическая связь в которой образована двумя электронами (типа 1 s), принадлежащими атомам водорода. Если удалить один электрон, то получаем еще более простую систему H2+– молекулярный ион водорода, в котором химическая связь осуществляется одним электроном. Эта устойчивая частица с межъядерным расстоянием re (H2+) = 0,106 нм энергией диссоциации D 0(H2+) = 2,65 эВ. С точки зрения квантовой механики эта задача многоцентровая, один электрон вращается вокруг ядер (рис. 5.10).
Уравнение Шредингера для такой системы запишется в виде (5.15), где  – волновая функция молекулярного иона H2+, которая составляется из волновых функций атома водорода в виде
– волновая функция молекулярного иона H2+, которая составляется из волновых функций атома водорода в виде
 = с 1j1 + с 2j2, (5.17)
= с 1j1 + с 2j2, (5.17)
где j1и j2 – атомные волновые функции (1 s атомные орбитали водорода); с 1и с 2 – коэффициенты, которые требуется определить; Ĥ – оператор Гамильтона, имеющий вид
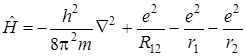 . (5.18)
. (5.18)
Последние три члена дают значение потенциальной энергии ядерного и электрон-ядерного взаимодействия, R 12 – расстояние между ядрами, r 1 и r 2 – расстояния от электрона до соответствующих ядер.
Как следует из рис. 5.10, один электрон движется вокруг двух ядер, которые предполагаются неподвижными. Такая задача в квантовой механике точно не решается, поэтому будем рассматривать приближенное ее решение методом МО. Это позволит нам познакомиться с наиболее характерными особенностями метода. Качественно будет раскрыта физическая картина образования химической связи, несмотря на приближенные значения параметров с 1и с 2 при записи волновой функции. Основы теории метода для простейшего иона H2+ послужат исходным пунктом для понимания природы химической связи в более сложных молекулах.

Задачу о нахождении коэффициентов с 1и с 2 и энергии системы H2+будем решать при помощи вариационного метода. Суть метода заключается в следующем. Умножим обе части уравнения (5.15) на комплексно–сопряженную волновую функцию Ψ * и проинтегрируем по всей области изменения переменных. В результате получим выражение:
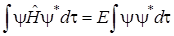 , (5.19)
, (5.19)
где d τ – элементарный объем (в декартовой системе координат d τ = dx dy dz).
Если известна волновая функция  (у нас она задана с коэффициентами с 1и с 2) и гамильтониан Ĥ, то можно вычислить энергию системы Е. в состоянии устойчивого равновесия (re (H2+) = 0,106 нм), энергия системы H2+должна быть минимальной.
(у нас она задана с коэффициентами с 1и с 2) и гамильтониан Ĥ, то можно вычислить энергию системы Е. в состоянии устойчивого равновесия (re (H2+) = 0,106 нм), энергия системы H2+должна быть минимальной.
Подставив в выражение для энергии (5.19) значение функции (5.17), получим
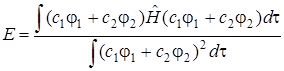 . (5.20)
. (5.20)
Выполнив соответствующие преобразования получим
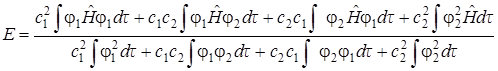 . (5.21)
. (5.21)
В целях упрощения записи (5.21) введем обозначения интегралов:
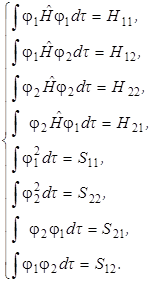 (5.22)
(5.22)
Из свойств интегралов перекрывания следует, что S 12 = S 21. учитывая далее коммутационные свойства оператора Гамильтона, можно показать, что Н 2 1 = Н 12.
Подставив в (5.21) значения интегралов (5.22), получим
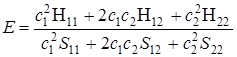 . (5.23)
. (5.23)
Рассчитать значение энергии по (5.23) можно, если известны значения коэффициентов с 1и с 2. Однако они в условиях нашей задачи не известны. Для их нахождения используют вариационный метод, согласно которому функции Ψ (5.17) должен отвечать минимум энергии Е. Условием минимума Е как функции с 1и с 2 будет равенство нулю частных производных: 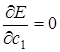 и
и 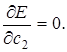
Найдем вначале частную производную от Е по с1 и приравняем ее нулю.
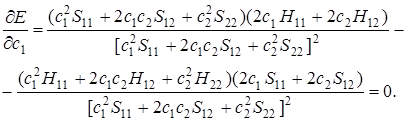 (5.24)
(5.24)
После преобразования получим
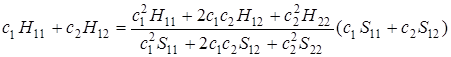 . (5.25)
. (5.25)
Сравнив (5.23) и (5.25), можем записать
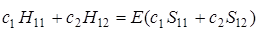 . (5.26)
. (5.26)
Сгруппировав по переменным с 1и с 2, перепишем (5.26) следующим образом:
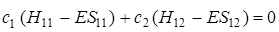 . (5.27)
. (5.27)
Дифференцируя значение энергии (5.24) по с 2, аналогично получим
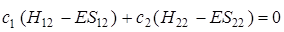 . (5.28)
. (5.28)
Выражения (5.27) и (5.28) представляют линейную систему уравнений с двумя неизвестными с 1и с 2. Для разрешимости этой системы необходимо, чтобы определитель, состоящий из коэффициентов при неизвестных, был равен нулю, т. е.
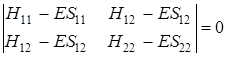 . (5.29)
. (5.29)
Так как МО образована из двух атомных функций, то получили определитель второго порядка, при комбинации трех атомных волновых функций получили бы определитель третьего порядка и т. д. Цифры в индексах совпадают с номером строки (первая) и с номером столбца (вторая). Это соответствие можно обобщить на функции, являющиеся линейной комбинацией n атомных орбиталей. Получим тогда определитель n -го порядка типа
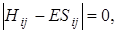 (5. 30)
(5. 30)
где i и j имеют n значений.
Определитель можно упростить, положив интегралы S 11 = S 22 = 1, если атомные волновые функции нормированы. Интеграл S12 обозначим через S. В нашем случае Н 11 = Н 22, так как атомные волновые функции φ1и φ2 одинаковы. Обозначим интегралы Н 11 = Н 22 = α, а Н 12через β. Тогда определитель (5.29) будет иметь вид
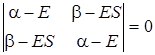 . (5.31)
. (5.31)
Раскрыв этот определитель, получим
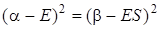 , (5.32)
, (5.32)
откуда
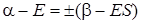 . (5.33)
. (5.33)
Решив уравнение (5.33) относительно Е, получим два значения энергии
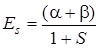 . (5.34)
. (5.34)
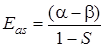 . (5.35)
. (5.35)
Итак, при решении уравнения Шредингера с известной волновой функцией с точностью до коэффициентов с 1и с 2 получим два собственных значения энергии. Определим значения коэффициентов с 1ис2, вернее их соотношение, так как из двух уравнений (5.27) и (5.28) нельзя получить три неизвестных – Е, с 1и с 2. Зная значение Еs из (5.33) можно найти отношение с 1/ с 2 из (5.28)
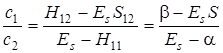 . (5.36)
. (5.36)
Подставив значения Еs из (5.34) в последнее уравнение, получим
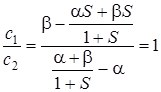 , (5.37)
, (5.37)
откуда с 1= с 2 = сs.
Аналогично, подставив в (5.28) вместо Е значение Е as, получим второе возможное соотношение:
с 1/ с 2 = –1 или с 1 = – с 2 = с as. (5.38)
Подстановка (5.37) и (5.38) в (5.17) приводит к двум решениям уравнения Шредингера для H2+, к двум молекулярным орбиталям:
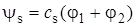 , (5.39)
, (5.39)
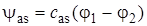 . (5.40)
. (5.40)
Для определения численного значения коэффициентов с sи с as воспользуемся условием нормировки молекулярной функции:
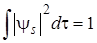 . (5.41)
. (5.41)
Подстановка вместо  s его значения из (5.39) дает следующее выражение:
s его значения из (5.39) дает следующее выражение:
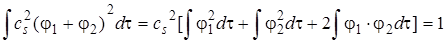 . (5.42)
. (5.42)
Первое и второе слагаемые в правой части равны единице, так как φ1 и φ2 нормированы. Тогда
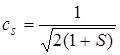 . (5.43)
. (5.43)
Аналогично находится коэффициент сas:
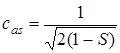 . (5.44)
. (5.44)
Если интегралом перекрывания S пренебречь по сравнению с единицей (хотя для иона H2+ и молекулы H2 он сравним с единицей, однако ради общности им пренебрегают), то будем иметь:
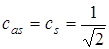 . (5.45)
. (5.45)
Из (5.39) и (5.40) получаем две молекулярные волновые функции, соответствующие двум значениям энергии Еs и Еas,
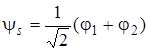 , (5.46)
, (5.46)
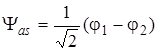 . (5.47)
. (5.47)
Обе МО являются приближенными решениями уравнения Шредингера, полученного вариационным методом. Одно из них с более низкой энергией (Ψ s) отвечает основному, второе (Ψ аs) – ближайшему более высокому состоянию.
По полученным волновым функциям (5.46) и (5.47) можно определить распределение электронной плотности в молекулярном ионе H2+, соответствующее энергиям Еs и Еas.
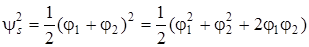 , (5.48)
, (5.48)
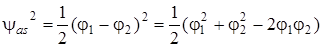 . (5.49)
. (5.49)
Как видно, симметричная функция ведет к увеличению плотности электронного заряда в области перекрывания атомных волновых функций (в межъядерном пространстве А и В) по сравнению с плотностью зарядов, описываемых функциями φ12 и φ22. Антисимметричная волновая функция ведет к уменьшению плотности заряда. На рис. 5.11 это изображено графически. Пунктирные линии изображают плотность заряда у индивидуальных атомов, удаленных один от другого на бесконечно большое расстояние, а сплошная линия – распределение электронной плотности в молекулярном ионе водорода вдоль межъядерной оси. Очевидно, что симметричная волновая функция (5.46) благоприятствует такому распределению заряда, при котором он концентрируется между ядрами. Такая МО называется связывающей. И наоборот, асимметричная МО (5.47) ведет к уменьшению плотности заряда в межъядерном пространстве и концентрации его около индивидуальных атомных ядер.
Такую МО называют антисвязывающей или разрыхляющей. Следовательно, только симметричная функция обусловливает образование устойчивой молекулы (H2+). На кривой зависимости потенциальной энергии от расстояния между ядрами (RАВ) (см. рис. 5.11) на каком-то из этих расстояний окажется минимум. Получим две потенциальные кривые: одну для связывающей орбитали, а вторую для разрыхляющей (рис 5.12).
В значения энергии Еs (5.34) и Еas (5.35) входят одни и те же интегралы α, β и S, однако величины энергии неодинаковы вследствие различия знаков в правых частях.


Проанализируем более детально интегралы 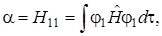
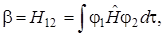
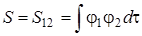 . Подставим оператор Гамильтона (5.34) в первый интеграл. Тогда получим:
. Подставим оператор Гамильтона (5.34) в первый интеграл. Тогда получим:
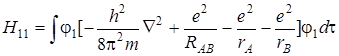 . (5.50)
. (5.50)
интеграл может быть упрощен, если учесть, что 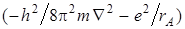 – оператор Гамильтона для атома водорода с электроном около ядра А. Он дает значение энергии Е 0 в атоме водорода. оператор Гамильтона для молекулярного иона водорода может быть записан следующим образом:
– оператор Гамильтона для атома водорода с электроном около ядра А. Он дает значение энергии Е 0 в атоме водорода. оператор Гамильтона для молекулярного иона водорода может быть записан следующим образом:
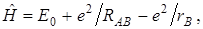 (5.51)
(5.51)
где Е 0 – энергия основного состояния водородного атома.


Величина интеграла (5.50) перепишется следующим образом:
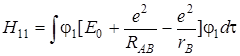 . (5.52)
. (5.52)
Величины Е 0 и RАВ – постоянные и их можно вынести за знак интеграла:
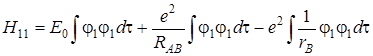 (5.53)
(5.53)
Так как волновая функция φ1 нормирована, т. е. 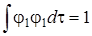 , то
, то
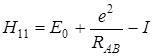 , (5.54)
, (5.54)
где I обозначает интеграл, названный Кулоновским
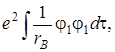 (5.55)
(5.55)
вычислить который не очень просто, но тем не менее он дает существенный вклад в общую энергию системы.
Таким образом, интеграл Н 11 = Н 22= α, как видно из (5.54), состоит из трех частей и передает классическое кулоновское взаимодействие частиц. Он включает энергию электрона в атоме водорода в основном состоянии (Е 0), кулоновское отталкивание ядер (е 2/ RАВ) и энергию I кулоновского взаимодействия второго протона (В) с электронным облаком, окружающим первый протон (А). на расстояниях порядка равновесного межъядерного этот интеграл отрицателен, а на больших расстояниях, где отталкивание ядер мало, он практически равен энергии электрона на атомной орбитали, поэтому в нулевом приближении он принимается равным энергии электрона в атоме водорода (Е 0). Только на расстояниях, значительно меньших равновесного, он становится положительным и возрастает неограниченно.
Интеграл Н 12 = Н 21 = β называют обменным или резонансным. Энергия, выражаемая интегралом β, не имеет аналога в классической физике. Он описывает добавочное понижение энергии системы, которое возникает из–за возможности перехода электрона от ядра А к ядру В, как бы обменивая состояния φ1 и φ2. Этот интеграл на бесконечности равен нулю, на всех других расстояниях (кроме очень коротких, меньших межъядерных) – отрицателен. Его вклад и определяет энергию химической связи (чем больше этот интеграл, тем прочнее связь). По аналогии с (5.53) этот интеграл можно записать следующим образом:
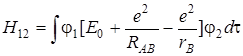 . (5.56)
. (5.56)
Вынося постоянные члены за знак интеграла, получим
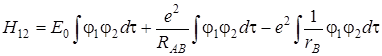 . (5.57)
. (5.57)
интеграл перекрывания атомных орбиталей 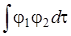 (обозначен S 12 = S 21 = S), образующих молекулярную орбиталь есть величина безразмерная и равна единице при RАВ = 0 спадает до нуля при возрастании межъядерного расстояния. На расстояниях между атомами, близких или равных равновесным, обменный интеграл Н 12 тем больше по абсолютной величине, чем больше интеграл перекрывания.
(обозначен S 12 = S 21 = S), образующих молекулярную орбиталь есть величина безразмерная и равна единице при RАВ = 0 спадает до нуля при возрастании межъядерного расстояния. На расстояниях между атомами, близких или равных равновесным, обменный интеграл Н 12 тем больше по абсолютной величине, чем больше интеграл перекрывания.
Действительно, равенство (5.57) можно переписать следующим образом, если ввести обозначения S 12и K
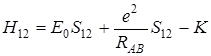 , (5.58)
, (5.58)
где K обозначает интеграл типа
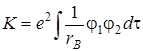 , (5.59)
, (5.59)
называемый обменным интегралом.
Последний интеграл в (5.57) и дает основную отрицательную добавку в общий обменный интеграл Н 12.
Если значения всех полученных интегралов подставить в уравнения для энергии (5.34) и (5.35) симметричного и асимметричного состояний, то получим
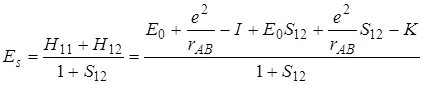 (5.60)
(5.60)
или
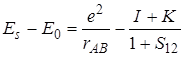 . (5.61)
. (5.61)
Для антисимметричного состояния получим следующее значение
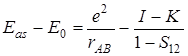 . (5.62)
. (5.62)
Вычисления интегралов I и K довольно сложны, однако есть возможность оценить их зависимость от расстояния между ядрами атомов водорода. Результаты этой зависимости изображены кривыми потенциальной энергии на рис. 5.12.
Как видно из рис. 5.12, симметричное энергетическое состояние ведет к минимуму потенциальной энергии, поэтому образуется устойчивая частица H2+. Антисимметричное состояние соответствует неустойчивому энергетическому состоянию. в этом случае электрон будет на антисимметричной орбитали и молекулярный ион H2+ не образуется. Следовательно, Es отвечает основному состоянию, а Eas – первому возбужденному состоянию молекулярного иона H2+.
Если приближенно считать, что S 12 = 0 и сохранить обозначения для Н 11и Н 12 соответственно через α и β, то выражения для волновых функций электрона в молекуле и его энергии приобретают простой вид:
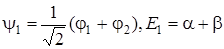 , (5.63)
, (5.63)
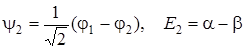 . (5.64)
. (5.64)
Так как интеграл β отрицателен, то E 1 < E 2.
Таким образом, метод МО показывает, что при соединении двух атомов в молекулу возможны два состояния электрона: – две молекулярные орбитали  1 и
1 и  2, одна из них с более низкой энергией E 1, другая – с более высокой энергией E 2. Поскольку на МО возможно пребывание как двух, так и одного электрона, то метод МО позволяет оценивать вклад в химическую связь не только электронных пар, но и отдельных электронов.
2, одна из них с более низкой энергией E 1, другая – с более высокой энергией E 2. Поскольку на МО возможно пребывание как двух, так и одного электрона, то метод МО позволяет оценивать вклад в химическую связь не только электронных пар, но и отдельных электронов.
Метод МО ЛКАО для иона H2+ дает величины E 0 = 1,77 эВ и r 0 = 0,13 нм, а согласно экспериментальным данным E 0 = 2,79 эВ и r 0 = 0,106 нм, т. е. расчет качественно согласуется с экспериментальными данными.
Если при образовании молекулы из атомов электрон займет нижнюю орбиталь, то полная энергия системы понизится – образуется химическая связь.
Поэтому волновую функцию  1 (соответствует
1 (соответствует  s)называют связывающей орбиталью. Переход электрона на верхнюю орбиталь
s)называют связывающей орбиталью. Переход электрона на верхнюю орбиталь  2 (соответствует
2 (соответствует  as ) увеличит энергию системы. связь при этом не образуется, система станет менее устойчивой. Такую орбиталь называют разрыхляющей. Связывающее и разрыхляющее действие электронов определяется видом волновых функций
as ) увеличит энергию системы. связь при этом не образуется, система станет менее устойчивой. Такую орбиталь называют разрыхляющей. Связывающее и разрыхляющее действие электронов определяется видом волновых функций  1 и
1 и  2.
2.
В молекуле водорода H2 на нижней связывающей орбитали размещается два электрона, что приводит к увеличению силы связи и понижению энергии связывающей орбитали. Результаты расчета по методу МО для молекулы водорода H2 приводят к значению Е 0 = 2,68 эВ и r 0 = 0,085 нм, а эксперимент дает значения Е 0 = 4,7866 эВ и r 0 = 0,074 нм. По порядку величины результаты согласуются, хотя энергия самого низкого состояния отличается чуть ли не в два раза от значения, полученного экспериментально. Аналогичным образом образуются молекулярные орбитали и для других двухатомных молекул, состоящих из более тяжелых атомов.
5.4. Типы химических связей
в двухатомных молекулах.
σ - и π - связи
Наиболее распространенными видами связи в молекулах являются σ- и π-связи, которые образуются в результате перекрывания электронных облаков внешних (валентных) электронов. Имеются и другие виды химических связей, которые характерны для комплексных соединений, содержащих атомы наиболее тяжелых элементов.
На рис. 5.13 и 5.14 приведены типичные варианты перекрывания s-, р - и d- электронных облаков при образовании химических связей. Перекрывание их происходит таким образом, чтобы при данной длине связи область перекрывания оказалась наибольшей, что отвечает максимально возможной силе химической связи.
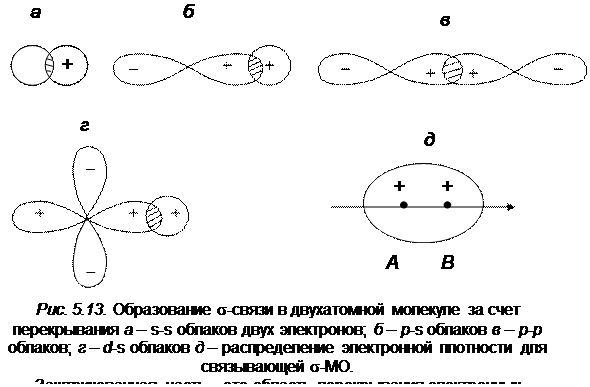

Под σ-связью в молекуле будем понимать такую связь, которая образуется за счет перекрывания внешних s - или p -электронов. при этом перекрывании электронное облако в пространстве между атомами обладает цилиндрической симметрией относительно оси, проходящей через ядра атомов (см. рис. 5.13) Область перекрывания облаков при цилиндрически расположенной электронной плотности лежит на оси связи. Волновая функция определяется величиной электронной плотности в межъядерном пространстве (см. рис. 5.13). Максимальная электронная плотность описывается σ-связывающей МО орбиталью, а минимальная – σ*‑разрыхляющей. В связывающих МО электронная плотность между ядрами наибольшая и отталкивание ядер уменьшается. Энергия молекулы меньше, чем энергия АО, молекула устойчива, интеграл перекрывания S > 0. В антисвязывающих (или разрыхляющих) МО электронная плотность между ядрами равна нулю, увеличивается отталкивание ядер, энергия МО больше, чем энергия АО. Состояние молекулы неустойчиво, интеграл перекрывания S < 0.


Каждая пара АО, образующая МО, дает две молекулярные орбитали (связывающую и антисвязывающую), что находит отражение в появлении двух энергетических уровней и соответственно потенциальных кривых (см. рис. 5.12). В нормальном состоянии связывающие орбитали заполнены электронами.
Кроме связывающей и разрыхляющих орбиталей имеются несвязывающие орбитали. Обычно это АО атома, не образующего химических связей. Интеграл перекрывания в данном случае равен нулю. Что имеет место в том случае, если АО относятся к различным типам симметрии.
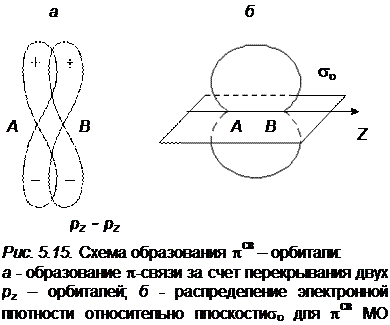
Наряду с σ-связями в молекуле могут существовать и π-связи, которые образуются в результате перекрывания атомных р-орбиталей или d - и р -орбиталей (рис. 5.14).
Электронное облако π-связи не обладает аксиальной симметрией. Оно симметрично относительно плоскости, проходящей через ось молекулы. Плотность электронного облака обращается в этой плоскости в нуль. На рис. 5.15 показано образование π-связи и электронная плотность для
πсв-орбитали. π-связь слабее σ-связи, и на диаграмме уровней энергия π–связи изображается выше энергии σ-связи. Электронные конфигурации молекулы и заполнение электронами различных оболочек проводится таким же образом, как и для атомов. Электроны помещаются последовательно по два с учетом принципа Паули (начиная с более низкой МО и заканчивая более высокой) с противоположными спинами на каждый энергетический уровень (без учета вырождения).
Рассмотрим химические связи в простейших двухатомных молекулах, их энергетические уровни и заполнение их электронами.

Известно, в ионе молекулы Н2+ химическая связь осуществляется одним 1 s -электроном, и находится он на связывающей орбитали σs. Это означает, что из 1 s -атомной орбитали образуется связывающая молекулярная σ-орбиталь. для молекулы водорода Н2 уже два 1 s электрона образуют аналогичную орбиталь – (σs)2. Можно считать, что два связывающих электрона соответствуют одинарной химической связи. Рассмотрим электронное строение молекулы Не2. Атом гелия содержит два валентных (1 s -электрона) электрона, поэтому при рассмотрении молекулы мы должны четыре валентных электрона разместить на молекулярных орбиталях. Согласно принципу Паули два из них разместятся на связывающей σs-орбитали, а два других на разрыхляющей σs*-орбитали. Электронное строение этой молекулы можно записать следующим образом:
Не2 [(σs)2 (σs*)2].
Поскольку один разрыхляющий электрон уничтожает действие связывающего электрона, то такая молекула существовать не может. У нее два связывающих и два разрыхляющих электрона. Порядок химической связи равен нулю. А вот ион Не2+ уже существует. для него электронное строение будет иметь следующий вид:
Не2+[(σs)2 (σs*)1].
Один разрыхляющий электрон не компенсирует двух связывающих.
Рассмотрим образование молекул из атомов элементов второго периода таблицы Менделеева. Для этих молекул будем считать, что электроны заполненного слоя не принимают участия в химической связи. В молекуле Li2 имеются два связывающих (2 s) электрона – Li2 (σs)2. Молекула Ве2 должна иметь электронную конфигурацию
Ве2[(σs)2 (σs*)2],
в которой на молекулярных орбиталях располагаются четыре электрона (по два 2 s -электрона от каждого атома). Число связывающих и разрыхляющих электронов одинаково, поэтому молекулы Ве2 не существует (здесь полная аналогия с молекулой Не2).
В молекуле В2 на молекулярных орбиталях приходится размещать шесть электронов (четыре 2 s -электрона и два 2 р -электрона). Электронная конфигурация запишется следующим образом:
В2 [(σs)2 (σs*)2 (π x) (π y)].
Два электрона в молекуле В2 располагаются по одному на π x - и π y -орбиталях с одинаковой энергией. По правилу Гунда они имеют параллельные спины (на одной орбитали не могут располагаться два электрона с одинаковыми спинами). Действительно, эксперимент показывает наличие в этой молекуле двух неспаренных электронов.
В молекуле углерода С2 на молекулярных орбиталях нужно разместить восемь валентных электронов (два 2 s -электрона и два 2 р электрона одного и другого атомов). Электронное строение будет выглядеть следующим образом:
С2 [(σs)2 (σs*)2 (π x)2 (π y)2].
В молекуле С2 разрыхляющих электронов два, а связывающих шесть. Избыток связывающих электронов равен четырем, поэтому связь в этой молекуле двойная. Связь в молекуле азота N2 осуществляется электронами 2 s 2 и 2 р 3. Рассмотрим только участие в связи трех неспаренных p -электронов. 2 s -электрона составляют заполненную оболочку и их участие в образовании связи близко к нулю. Облака трех px, py, pz электронов простираются в трех взаимно перпендикулярных направлениях. Поэтому в молекуле азота возможна лишь s-связь за счет концентрации электронной плотности вдоль оси z (рис. 5.16), т. е. s образуется за счет пары pz -электронов. Остальные две химические связив молекуле N2 будут только p-связями (за счет перекрывания px – px, py – py электронов. на рис. 5.16, б это перекрывание показано отдельно.
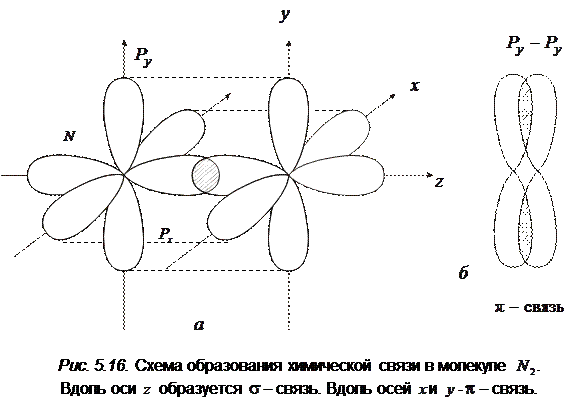

Таким образом, три общие электронные пары в молекуле азота образуют одну s-и две p-связи. В этом случае говорят о тройной химической связи. Два атома не могут быть связаны между собой более чем тремя электронными парами. Электронная конфигурация молекулы N2 имеет следующий вид:
N2[(σs)2 (σ x *)2 (π x , y )4 (σ z)2].
Высшей занятой орбиталью считается σ z -орбиталь, образованная за счет перекрытия двух р -орбиталей, лепестки которых направлены вдоль оси связи (ось z). Это обусловлено закономерностью изменения энергии 2 s - и 2 р -электронов с ростом порядкового номера элемента.
В молекуле кислорода О2 по молекулярным орбиталям должны быть распределены двенадцать валентных электронов, два из которых, по сравнению с молекулой N2, должны занять разрыхляющие орбитали. Общее электронное строение запишется так:
О2 [(σs)2 (σs*)2 (σz)2 (π x)2, (π y)2 (π x *)1 (π y *)1].
Как и в молекуле B2, два электрона с параллельными спинами занимают две различные π-орбитали. Это обусловливает парамагнитные свойства молекулы кислорода, что соответствует опытным данным. Избыток четырех связывающих электронов обеспечивает порядок связи в молекуле, равный двум.
В следующей за кислородом молекуле F2 надо дополнительно расположить на орбиталях 2 валентных р -электрона, поэтому молекула фтора будет иметь следующее электронное строение:
F2 [(σs)2 (σs*)2 (σ z)2 (π x)2 (π y)2 (π x *)2 (π y *)2].
Избыток двух связывающих электронов характеризует одинарную химическую связь в молекуле F2.
Легко показать, что молекулы Ne2 не существует, так как в ней число связывающих электронов равно числу разрыхляющих.
Рассмотрим электронное строение отдельных двухатомных молекул, состоящих из разнородных атомов, на примере молекулы СО. В молекуле СО на молекулярных орбиталях располагается десять валентных электронов. Ее электронное строение аналогично электронному строению N2, в которой также десять валентных электронов располагаются на тех же молекулярных орбиталях. Этим объясняется близость химических и физических свойств этих молекул. На рис. 5.17 приведена диаграмма уровней энергии МО в молекуле СО.
Из диаграммы видно, что уровни энергии 2 s -электронов углерода и кислорода значительно различаются, поэтому их линейная комбинация не может соответствовать реальной МО в данной молекуле, как это могло следовать из упрощенных комбинаций. 2 s -электроны кислорода остаются в молекуле на том же энергетическом уровне, что и в атоме, образуя несвязывающую молекулярную орбиталь (sH). 2 s – АО углерода при линейной комбинации с соответствующей по симметрии 2 р - АО кислорода (2 рz) образуют связывающую s и разрыхляющую s*молекулярную орбитали. При линейной комбинации 2 рx и 2 рy – АО углерода и кислорода образуются молекулярные орбитали p x (связывающая) и π x *(разрыхляющая) и аналогично p y и p y*. 2 рz – АО углерода, на которую перейдет один s -электрон в результате реакции будет второй несвязывающей
pН-орбиталью. На нее перейдет дополнительно один из р -электронов кислорода. Таким образом, десять валентных электронов в молекуле СО заполняют три связывающие и две несвязывающие МО. Электронная конфигурация внешних электронов молекулы СО будет выглядеть следующим образом:
(σН)2 (σ)2 (π x,y)4 (πH)].
В молекуле NО на орбиталях нужно расположить одинадцать электронов, что приведет к строению электронной оболочки типа:
NО [(σ s)2 (σ s *)2 (π x)2 (π y)2 (σ z)2 (π x *)].


Как видно, число избыточных связывающих электронов равно пяти. С точки зрения порядка химической связи надо ввести дробное число, равное 2,5, для ее характеристики. Если в этой молекуле удалить один электрон, то получится ион NO+ с более прочной межатомной связью, так как число связывающих электронов здесь будет равно шести (удален один электрон с разрыхляющей π x *-орбитали).
Если два атома могут связываться только одной общей парой электронов, то между такими атомами всегда образуется σ-связь. π-связь осуществляется в том случае, если два атома связываются двумя или тремя общими электронными парами. Типичным примером может служить молекула азота. Химическая связь в ней осуществляется за счет трех неспаренных px, py, и pz -электронов. Угловые лепестки их орбиталей простираются в трех взаимно перпендикулярных направлениях. Если за линию связи принять ось z, то перекрывание рz -атомных орбиталей дадут одну σ z -связь. Остальные орбитали px и py дадут только π-связи. Таким образом, три пары связывающих электронов дают одну σ-связь и две π-связи. Итак, все одинарные химические связи между атомами являются σ-связями. В любой кратной связи одна σ-связь, а остальные – π-связи.
5.5. Систематика электронных состояний
в двухатомной молекуле
Для систематики электронных состояний в двухатомных молекулах, аналогично как и в атомах, вводятся определенные квантовые числа, характеризующие орбитальное и спиновое движение электронов. Наличие электрических и магнитных полей как в молекулах, так и в атомах, приводит к векторному сложению орбитальных и спиновых моментов количества движения. Однако в двухатомной молекуле валентные электроны движутся не в сферически-симметричном электрическом поле, что характерно для атома, а в аксиально-симметричном, что характерно для двухатомных или линейных многоатомных молекул. Все двухатомные молекулы относятся к двум типам симметрии: D ∞ h или С ∞u. К первому типу относятся молекулы, состоящие из одинаковых атомов, ко второму – из разноименных. Ось бесконечного порядка направлена вдоль химической связи. в том же направлении действует и электрическое поле, которое сильно влияет на полный орбитальный момент, вызывая его прецессию вокруг оси поля. В результате этого полный орбитальный момент перестает квантоваться, а сохраняется лишь квантование его проекции Lz на ось молекулы:
Lz = mL· ħ,(5.65)
где mL – квантовое число, принимающее значения mL = 0, ±1, ±2и т. д. При этом энергия электронного состояния зависит только от абсолютного значения mL , что соответствует тому факту, что с наглядной точки зрения оба вращения электрона (правое и левое) вокруг оси молекулы приводят к одному и тому же значению энергии. Введем некоторую величину Λ, которая характеризует абсолютную величину проекции полного орбитального момента на ось молекулы. Тогда значения Λ будут целыми положительными числами, различающимися на одну единицу Λ = ê mL ê = 0, 1,2,...
Для классификации электронных состояний двухатомной молекулы числа Λ играют ту же роль, что и орбитальное квантовое число l для классификации электронных состояний атомов. Общее суммарное квантовое число для атомов принято обозначать 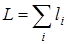 , где суммирование производится по всем электронам атома. Если L = 0, то такие электронные состояния обозначаются буквой s; если L = 1, то электронные состояния обозначаются буквой р., т. е.
, где суммирование производится по всем электронам атома. Если L = 0, то такие электронные состояния обозначаются буквой s; если L = 1, то электронные состояния обозначаются буквой р., т. е.
| s, p, d,... | |
| L= | 0, 1, 2, ... |
Пользуюясь обозначениями электронных состояний для атома, электронные состояния для молекулы с последовательными значениями Λ принято обозначать прописными греческими буквами:
| Λ= | 0, 1, 2, 3,... |
| состояния | Σ, Π, Δ, Φ,... |
Для двухатомных молекул обычно приходится иметь дело со значениями Λ, не превышающими 2. Для нормальных состояний молекул Λ преимущественно равно 0 (Σ-состояния). Возбужденные состояния двухатомных молекул имеют в большинстве случаев Λ= 0 и Λ= 1
(Σ- и П-состояния).
Все значения энергии с Λ ≠ 0 являются дважды вырожденными, что соответствует двум значениям проекции орбитального момента – положительным и отрицательным (mL = Λи mL = –Λ). Σ-состояния, для которых Λ = 0, являются невырожденными.
На полный спиновый момент молекулы S, в отличие от полного орбитального момента L, аксиально-симметричное электрическое поле не действует. Поэтому полный спиновый момент S квантуется обычным образом приближенно сохраняя свое значение. При заданном значении S полный спиновый момент может ориентироваться æ = 2 s + 1 способами, что для молекулы, аналогично как и для атома, определяет мультиплетность æ электронных состояний. В зависимости от значений æсостояния могут быть синглетными (æ = 1), дублетными (æ= 2), триплетными (æ = 3) и т. д. индекс, указывающий мультиплетность, ставится слева вверху соответствующей прописной буквы.
Например, синглетные состояния 1Σ, 1Π, 1Δ,...,
дублетные ‑ 2Σ, 2Π, 1Δ,...,
триплетные ‑ 3Σ, 3Π, 3Δ,...
Для характеристики электронных состояний линейных молекул важную роль играют элементы симметрии σu для гетеронуклеарных (молекул с разными атомами) и центр инверсии i гомонуклеарных молекул (с одинаковыми атомами). По отношению к отражению в плоскости симметрии σu, проходящей через ось молекулы, электронные состояния разделяются на положительные (+) и отрицательные (–). Для положительных состояний электронов волновая функция не меняет знак при отражении в плоскости σu, а для отрицательных состояний ‑ меняет на противоположный, т. е.
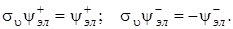
Следовательно, все Σ-состояния как невырожденные, являются либо положительными (Σ+), либо отрицательными (Σ–). Все дважды вырожденные состояния, для которых Λ ≠ 0, представляют собой совокупность положительных и отрицательных состояний. Если вырождение снимается, то дважды вырожденный уровень расщепляется на два, один из которых будет положительным, а другой ‑ отрицательным.
Если молекула относится к точечной группе D ∞ h, то электронные состояния делятся по отношению к отражению в центре на четные (g) и нечетные (u). Каждое электронное состояние является либо четным, либо нечетным:
Σg+, Σg–, Π g, Δ g,...
Σ u +, Σ u –, Π u, Δ u,....
Таким образом, имеется четыре типа Σ-состояний и по два типа
П-, Δ-состояний.
Волновые функции оператора проекции орбитального момента количества движения 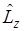 имеют вид
имеют вид
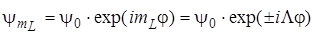 .
.
При Λ = 0 это значение дает одну функцию 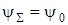 . Если Λ≠0, то получаются две функции
. Если Λ≠0, то получаются две функции
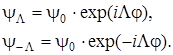
Закон совместного преобразования функций 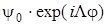 и
и 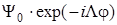 дает характеры для вырожденных состояний Π, Δ, Φ,...
дает характеры для вырожденных состояний Π, Δ, Φ,...
Если волновые функции 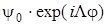 и
и 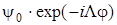 не обладают в отдельности свойством положительности или отрицательности по отношению к операции σ , то их линейные комбинации
не обладают в отдельности свойством положительности или отрицательности по отношению к операции σ , то их линейные комбинации
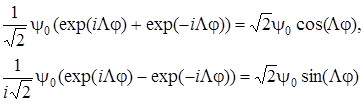
обладают этим свойством (это проверяется подстановкой φ = –φ).
Важно отметить, что из определенных электронных состояний исходных атомов возникает вполне определенный набор электронных состояний молекулы. На основании свойств симметрии можно установить характеристики этих состояний – значения квантовых чисел Λ и S, положительность или отрицательность Σ-состояний, четность или нечетность состояний для молекул, состоящих из одинаковых атомов. При каждом значении Λ состояния могут быть различной мультиплетности.
Спиновые моменты 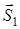 и
и 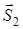 атомов при образовании молекулы векторно складываются в полный спин молекулы
атомов при образовании молекулы векторно складываются в полный спин молекулы 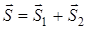 . Возможные значения спинового квантового числа молекулы равны
. Возможные значения спинового квантового числа молекулы равны
S = S 1 + S 2, S 1+ S 2 –1,..., |S 2 – S 1 |.
Соответственно мультиплетность æ состояния молекулы при заданных мультиплетностях æ1 и æ2 состояний атомов будет принимать значения
æ = æ1 + æ2–1, æ1 + æ2 – 3,..., |æ1 – æ2| + 1.
Например, при æ1 = æ2 = 2 имеем æ = 3, 1; при æ1 = 3, æ2 = 2 имеем æ = 4, 2; при æ1 = æ2=3 имеем æ = 5, 3, 1.
Рассмотрим несколько примеров получения состояний молекулы, если известны состояния атомов, из которых образована молекула.
Пусть из двух s -состояний атомов образуется молекула. Например, два атома водорода в основном состоянии 2 s образуют молекулу водорода. Орбитальные моменты электронов равны нулю, следовательно, образуются только Σ-состояния. В состоянии s находится только один электрон со спином s = 1/2, т. е. æ1 = æ2 = 2. поэтому образуются два состояния æ =3, 1. Таким образом образуется молекула в двух состояниях
1Σg+ и 3Σg –.
Из двух атомов азота в основном состоянии 4s возникают состояния молекулы азота N2 (æ = 1,3,5,7, æ1 = 4 и æ2 = 4) следующего вида 1Σ g +, 3Σ u +, 5Σ g –, 7Σ u +. Из двух атомов кислорода в основном состоянии 3 p (æ=1,3,5) получаются следующие состояния молекулы:
а) синглетные 1Σ g +, 1Σ g +, 1Σ u –, 1Π g,1Π u, 1Δ g
б) триплетные 3Σ u +, 3Σ u +, 3Σ g –, 3Πg,3Π u, 3Δ u
в) квинтетные 5Σ g +, 5Σ g +, 5 Σ u –, 5Π g,5Π u, 5Δ g
Таким образом, Σ-состояний получается столько, сколько раз комбинация орбитальных моментов атомов равна нулю (0 + 0=0, 1 – 1 = 0,
–1 + 1 = 0), Π-состояние получается столько, сколько раз орбитальное результирующее квантовое число равно 1 или –1 (Π-состояния дважды вырождены) (1 + 0 = 1 и –1 + 0 = –1, 0 + 1 = 1 и 0 – 1 = –1). Δ-состояний получается столько, сколько раз результирующий орбитальный момент равен 2 или –2.
Как видно, число получающихся состояний может быть большим. Однако устойчивыми оказываются только те состояния, которым соответствует минимум потенциальной энергии, остальные – неустойчивыми. Определить устойчивость или неустойчивость электронных состояний можно только на основе квантовомеханических расчетов энергии химических связей. Например, расчет на основе квантовой механики энергии связи для молекулы H2 позволил установить, что из двух возможных состояний 1Σ g + и 3Σ u +, возникающих при взаимодействии атомов водорода в основном состоянии 2s, первое устойчиво и является основным состоянием молекулы, а второе неустойчиво (ему соответствует типичная кривая отталкивания). В таблице 5.1 приведены обозначения термов основного состояния некоторых двухатомных молекул, межатомные расстояния и энергии химической связи.
Таблица 5.1
Электронные состояния, межатомные расстояния и энергия
химической связи некоторых двухатомных молекул.
| Молекула | Электронная конфигурация основного состояния | Межатомное расстояние, Ǻ | Энергия связи, эВ |
| H2 H2+ He2 He2+ | (σ g)2, 1Σ g + (σ g)1, 2 Σ g + (σ g)2 (σ u *)2, 1Σ g + (σ g)2 (σ u *)1, 2Σ u + | 0,07415 0,106 – 1,108 | 4,48 2,65 ~0 ~3 |
| O2 | (π u)4 (σ g)2 (π g *), 3Σ g – | 0,120741 | 5,1 |
| O2+ | (π u)4 (σ g)2 (π g *), 2П g | 0,11227 | 6,48 |
| O2– | (π u)4 (σ g)2 (π g *), 2П (?) | 0,126 | – |
| N2 | (π u)4 (σ g)2, 1Σ g + | 0,10976 | 9,75 |
| N2+ | (π u)4 (σ g)1, 2Σ g + | 0,1116 | 8,73 |
| C2 | (π u)3 (σ g)1, 3П u | 0,1117 | 6,5 |
| F2 | (π u)4 (σ g)2 (π g *)1, 1Σ g + | 0,1418 | 1,56 |
| LiH | (σs)2, 1Σ+ | 0,15953 | 2,51 |
| BeH | (σ s)2 (σ s *)1, 2Σ+ | 0,13431 | 2,29 |
| CH | (σ s)2 (σ s *)2 (π)1, 2П | 0,11198 | 3,47 |
| CO | (σ s) 2 (π x,y)4, 1Σ | 0,11282 | 11,08 |
| CN | (π x,y)4 (σ s) 1, 2Σ+ | 0,11718 | 8,15 |
| CF | (σ s)2 (π*)1, 2П | 0,127 | 6,59 |
| NO | (π x,y)4 (σ s)2 (π*)1, 2Π | 0,1150 | 8,02 |
| NP | (π x,y)4 (σ s)2, 1Σ | 0,14910 | 5,98 |
| PO | (π x,y)4 (σ s)1, 2Π | 0,1448 | 5,42 |
| NH | (σ s)2 (σ s *)2 (π x,y)2, 3Σ– | 0,1038 | 3,69 |
| HF | (σ s)2 (σ s *)2 (π x,y)4, Σ | 0,09175 | 5,81 |
5.6. Молекулярные электронные оболочки
в двухатомной молекуле
Электроны в молекуле, аналогично как и электроны в атоме, можно группировать в электронные молекулярные оболочки. В атомной физике в зависимости от значений орбитального квантового числа l мы различали s -, p -, d -, f -,... электроны и получали оболочки, которые заполняются 2, 6, 10, 14,... электронами. Введение квантового числа l было связано с приближенным представлением о том, что каждый электрон движется в сферически-симметричном поле ядра и остальных электронов. В двухатомной молекуле, как видно в п. 5.5, отдельный электрон движется в аксиально–симметричном поле ядер, расположенных на прямой, являющейся осью молекулы и остальных электронов. Поэтому вводят квантовое число λ, которое служит основной приближенной характеристикой одноэлектронного состояния молекулы. Это число определяет абсолютную величину проекции орбитального момента электрона на ось молекулы. Так как величина этой проекции
lz = ml ħ, где ml = 0, ±1, ±2, ... (5.66)
то λ принимает значения
λ = |ml| = 0, 1, 2, 3, ... (5.67)
Так как энергия электрона в молекуле зависит только от абсолютной величины проекции (на него действует аксиально-симметричное поле). состояние с λ = 0, 1, 2, 3, ... по аналогии с l = 0, 1, 2, 3, ... для атомов обозначают строчными греческими буквами
λ = 0, 1, 2, 3,...
σ, π, δ, φ,...
и говорят об σ-, π-, δ-, φ- ,... состояниях и σ-, π-, δ-, φ-,...электронах.
В молекуле число эквивалентных электронов данного рода (т. е. число электронов с определенным λ и с одинаковыми свойствами), согласно принципу Паули, не может быть больше двух. Эквивалентные
σ-электроны (λ = 0) могут отличаться лишь величиной проекции спина на ось молекулы (mS = 1/2 mS = –1/2). следовательно, получаем молекулярную оболочку σ2, заполняющуюся двумя электронами. Эквивалентные π-, δ-,... электроны могут отличаться знаком проекции орбитального момента и знаком проекции спина на ось молекулы (т. е. существуют четыре различных состояния ml = λ ms = 1/2; ml = λ, ms = –1/2; ml = –λ, ms = 1/2; ml = – λ, ms = –1/2) и получаются молекулярные оболочки π4, δ4,... заполняющиеся четырьмя электронами каждая. Таким образом, в линейных молекулах не существует молекулярных оболочек, заполняющихся более чем четырьмя электронами. При этом σ-оболочки заполняются двумя электронами, а π-, δ-,... оболочки (λ > 0) – четырьмя.
При прочих равных условиях энергия σ-электронов меньше, чем π-, δ-,... электронов, поэтому первоначально происходит заполнение σ-оболочек, а затем π-, δ-,... оболочек. Свойства σ- и π-электронов весьма существенны при изучении не только двухатомных, но и многоатомных молекул.
 2015-09-06
2015-09-06 13996
13996
