Электроаналитические (электрохимические)методы анализа основаны на использовании электрохимических процессов, происходящих в электролитической ячейке (гальваническом элементе, цепи). Электролитическая ячейка представляет собой электрохимическую систему, состоящую из электродов и электролитов, контактирующих между собой. На границе раздела фаз может происходить электродная реакция между компонентами этих фаз, в результате которой электрический заряд переходит из одной фазы в другую, и на межфазной границе устанавливается потенциал.
В отсутствие электрического тока (I = 0) в замкнутой гальванической цепи на межфазной границе устанавливается равновесие, и потенциал достигает равновесного значения. Если через ячейку проходит электрический ток (I # 0), на межфазной границе равновесие не достигается и в результате электродного процесса электроны переходят из электрода в раствор (или положительный заряд в обратном направлении).
В состав электролитической ячейки входят два или три электрода, один из которых индикаторный или рабочий, второй — электрод сравнения и третий — вспомогательный. Электрод, действующий как датчик, реагируя на фактор возбуждения и на состав раствора (не оказывая влияния на состав раствора во время измерения), является индикаторным. Если под действием тока, протекающего через ячейку, происходит значительное изменение состава раствора, электрод — рабочий. Электрод сравнения служит для создания измерительной цепи и поддержания постоянного значения потенциала индикаторного (рабочего) электрода. Используемый в трехэлектродной ячейке вспомогательный электрод (противоэлектрод) вместе с рабочим электродом включен в цепь, через которую проходит электрический ток.
Пример хлорсеребряного электрода сравнения приведен на рис. 2.1. Он состоим из серебряной проволочки, электролитически покрытой слоем хлорида серебра и погруженной в раствор хлорида калия, насыщенный хлоридом серебра.
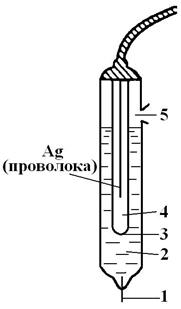 Рис. 2.1. Электрод сравнения хлорсеребряный 1 — асбестовое волокно, обеспечивающее контакт с анализируемым раствором; 2 — насыщенный раствор KCl; 3 — крошечное отверстие для контакта; 4 — внутренний раствор KCl (насыщенный); 5 — отверстие для ввода раствора KCl Рис. 2.1. Электрод сравнения хлорсеребряный 1 — асбестовое волокно, обеспечивающее контакт с анализируемым раствором; 2 — насыщенный раствор KCl; 3 — крошечное отверстие для контакта; 4 — внутренний раствор KCl (насыщенный); 5 — отверстие для ввода раствора KCl | Электрохимические методы анализа основаны на использовании зависимости электрических параметров от концентрации, природы и структуры вещества, участвующего в электродной (электрохимической) реакции или в электрохимическом процессе переноса зарядов между электродами. Электрохимические методы анализа можно классифицировать следующим образом: 1) методы без протекания электродной реакции, в которых строение двойного электрического слоя в расчет не принимается (кондуктометрия при низких и высоких частотах); 2) методы, основанные на электродных реакциях в отсутствие тока (потенциометрия) или под током (вольтамперометрия, кулонометрия, электрогравиметрия). |
Электрохимические методы анализа позволяют определять концентрацию вещества в широком интервале (1 – 10-9 моль/л) с достаточной точностью и воспроизводимостью.
 2015-09-06
2015-09-06 1011
1011
